
【题目】乳酸亚铁晶体[CH3CH(OH)COO]2Fe·3H2O(M=288 g/mol)是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸CH3CH(OH)COOH与FeCO3反应制得.
I.制备碳酸亚铁
(1)利用如图所示装置进行实验。装置中仪器C的名称是____________。

(2)实验开始时,首先关闭活塞2,打开活塞1、3,目的是________________________;关闭活塞1,反应一段时间后,关闭活塞_________,打开活塞___________,观察到B中溶液进入到C中,C中产生沉淀和气体。生成FeCO3的离子方程式为__________。
(3)装置D的作用是___________________。
Ⅱ.乳酸亚铁晶体的制备及纯度测定
将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸,从所得溶液中获得乳酸亚铁晶体。
(4)加入少量铁粉的作用是______________________________。
(5)用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其主要原因是____________________________________________。
(6)经查阅文献后,改用Ce(SO4)2标准溶液进行滴定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760 g样品,溶解后进行必要处理,用容量瓶配制成250 mL溶液,每次取25.00 mL,用0.1000 mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表所示:

则产品中乳酸亚铁晶体的纯度为________%(保留小数点后两位)。
【答案】三颈烧瓶 制备Fe2+,利用产生的氢气排净装置内的空气,防止Fe2+被氧化 3 2 Fe2++2HCO3=FeCO3↓+CO2↑+H2O 液封,防止空气中的氧气进入到C装置中,将Fe2+氧化 防止FeCO3与乳酸反应产生的Fe2+被氧化 乳酸根中的羟基被酸性高锰酸钾溶液氧化 97.50
【解析】
I. 制备碳酸亚铁
Fe粉与盐酸在装置B中反应制取FeCl2,亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,利用反应生成的氢气排尽装置中的空气,在C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,装置D防止空气中的氧气进入到C装置中,将Fe2+氧化,据此分析作答。
Ⅱ.乳酸亚铁晶体的制备及纯度测定
(4)考虑Fe2+被氧化;
(5)乳酸中的羟基消耗酸性高锰酸钾;
(6)第二组数据误差较大,舍去,计算出消耗的标准液体积平均为19.50 mL,根据Ce4++Fe2+=Ce3++Fe3+,则m(乳酸亚铁)=0.1000 mol/L×0.0195 L×![]() ×288 g/mol=5.616 g,据此计算可得。
×288 g/mol=5.616 g,据此计算可得。
I.(1)根据装置图可知:仪器C为三颈烧瓶;
(2)首先关闭活塞2,打开活塞1、3,目的是发生反应制备Fe2+,利用反应产生的H2排净装置内的空气,防止Fe2+被氧化;关闭活塞1,反应一段时间后,关闭活塞3,打开活塞2,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,发生反应:Fe2++2HCO3=FeCO3↓+CO2↑+H2O;
(3)装置D的作用是液封,防止空气中的氧气进入到C装置中,将Fe2+氧化;
II.(4)加入少量铁粉的作用是防止FeCO3与乳酸反应产生的Fe2+被氧化;
(5)乳酸根中的羟基容易被酸性高锰酸钾溶液氧化,故用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%;
(6)通过对实验数据分析、观察,发现第二组数据误差较大,要舍去,故消耗的标准液体积平均为19.50 mL,根据Ce4++Fe2+=Ce3++Fe3+,则m(乳酸亚铁)=0.1000 mol/L×0.0195 L×![]() ×288 g/mol=5.616 g,故产品中乳酸亚铁晶体的纯度为
×288 g/mol=5.616 g,故产品中乳酸亚铁晶体的纯度为![]() ×100%=97.50%。
×100%=97.50%。


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.将铜丝插入稀硝酸中:Cu+4H++2![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
B.漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.硫酸铜溶液与过量的氨水反应:Cu2++4NH3H2O=[Cu(NH3)4]2++4H2O
D.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图有机物的正确命名为 ( )
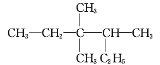
A.2-乙基-3,3-二甲基戊烷B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷D.3,4,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(n)由于其特殊的结构,一直受到结构和理论化学家的关注,它有如下转化关系。下列说法正确的是

A. n分子中所有原子都在同一个平面上
B. n和:CBr2生成p的反应属于加成反应
C. p分子中极性键和非极性键数目之比为2:9
D. m分子同分异构体中属于芳香族化合物的共有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,体积不变的密闭容器中,发生可逆反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
2SO3(g) ΔH<0,达到平衡后,当单独改变下列条件后,有关叙述正确的是
A. 增大压强,平衡正向移动,此反应的ΔH仍保持不变
B. 增大O2浓度,SO2的平衡转化率减小
C. 降低温度,化学平衡常数减小
D. 升高温度,SO2的转化率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作。步骤如下:
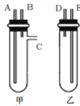
①将锌粒放于______(填“甲”或“乙”,下同)装置中,将稀硫酸放于______装置中。
②用橡胶管连接对应接口(填编号):A接______,B接______。
③将盛稀硫酸的试管倒置,即可发生反应放出气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家合成了一种新的化合物,其结构式如图所示。该物质中 W、X、Y、Z、M是短周期中常见元素,且原子序数依次增大;已知M元素原子核外电子总数是Y元素原子核外 电子总数的两倍。下列说法中错误的是
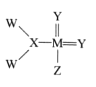
A.由X和Y两种元素形成的化合物有多种
B.W和Z元素位于周期表中同一主族
C.元素的非金属性强弱顺序为:Z>Y>X
D.Y、M元素的气态氢化物沸点高低为:Y>M
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com