
【题目】现有短周期元素A、B、C、D。A元素M层上有2对成对电子,D与A在周期表中同一主族。由A、B与D组成的化合物的浓溶液是常见的干燥剂,常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要的肥料。
完成下列填空。
(1)A的原子最外层电子排布式为______,该电子层内含______种不同运动状态的电子。描述集气瓶中足量的A的氢化物与其低价态氧化物混合后,充分反应的实验现象:______。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,其化学式是______。写出该化合物在实验室制备乙酸乙酯时所起的作用:______。
(3)B与C元素形成带一个单位正电荷的离子,写出该微粒的电子式___。写出实验室检验溶液中该离子的简单实验方案:_______。
(4)元素A与元素D相比,非金属性较强的是______(用元素符号表示),下列表述中能表明这一事实的是_______。
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
(5)C的氢化物固态时属于________晶体,该氢化物与少量A的最高价氧化物水化物反应的化学方程式是________。
【答案】3s23p4 6 有淡黄色粉末和无色液体生成 H2SO4 催化、吸水 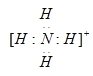 取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有铵根离子 O ②③ 分子 H2SO4+2NH3=(NH4)2SO4
取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有铵根离子 O ②③ 分子 H2SO4+2NH3=(NH4)2SO4
【解析】
现有短周期元素A、B、C、D,A元素M层上有2对成对电子,则A的M层含有6个电子,为S元素;D与A在周期表中同一主族,则D为O元素;由A、B与D组成的化合物的浓溶液是常见的干燥剂,该干燥剂为浓硫酸,则B为H元素;常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要的肥料,则C为N元素,据此结合元素周期律知识进行解答。
根据上述分析可知A是S元素,B是H元素,C是N元素,D是O元素;
(1)A为S元素,S原子的最外层含有6个电子,A的原子最外层电子排布式为3s23p4,最外层共有6种不同运动状态的电子;A的氢化物为H2S,S的低价态氧化物为SO2,H2S与SO2混合后生成硫单质和水,因此反应现象为:有淡黄色粉末和无色液体生成;
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,该干燥剂为浓H2SO4,在实验室中用乙醇和乙酸及浓硫酸混合加热,发生酯化反应产生乙酸乙酯和水,在制备乙酸乙酯中浓硫酸为催化剂和吸水剂;
(3)B与C元素形成带一个单位正电荷的离子,该离子为NH4+,其电子式为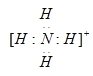 ,在实验室中检验NH4+的方法为:取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有铵根离子;
,在实验室中检验NH4+的方法为:取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有铵根离子;
(4)元素S与元素O相比,二者位于同一主族,由于原子序数越大,原子核外电子层数越多,原子半径越大,元素的非金属性越弱,因此元素的非金属性较强的是O元素;
①O元素没有含氧酸,无法据此判断非金属性强弱,①错误;
②元素的氢化物稳定性越强,说明该元素与H元素的原子结合力越强,则元素的非金属性就越强,因此可通过比较对应气态氢化物的稳定性,可以判断二者非金属性强弱,②正确;
③一定条件下氧气能从硫化氢的水溶液中置换出S单质,从而证明O的非金属性大于O,③正确;
④沸点大小与非金属性没有必然关系,无法根据沸点高低判断非金属性强弱,④错误;
故合理选项是②③;
(5)C为N元素,其氢化物为氨气,氨气是由分子构成的物质,在固态时属于分子晶体;A的最高价氧化物水化物为硫酸,氨气与硫酸发生反应产生硫酸铵,反应的化学方程式为:H2SO4+2NH3=(NH4)2SO4。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )
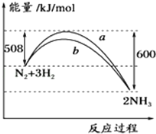
A. 加入催化剂,不能改变该化学反应的反应热
B. b曲线是加入催化剂时的能量变化曲线
C. 该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) H=﹣92 kJ/mol
2NH3(g) H=﹣92 kJ/mol
D. 在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国政府为消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾,现实验室需要配制480mL 0.1mol/LKIO3溶液,实际操作步骤有:
(1)需称量碘酸钾的质量为___g。
(2)配制溶液时下列仪器中:
A.锥形瓶 B.托盘天平 C.烧杯 D.胶头滴管 E.药匙 F.量筒
不需要用到的是__(填序号),尚缺的玻璃仪器有___和___(写名称)。
(3)人们常将配制过程简述为以下各步骤:
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移 H.装入试剂瓶
其正确的操作顺序应是___(填序号)。
①B E A G C G D F H ②B E G A C G F D H
③B E F G C G D H A ④B E A G C G D H F
(4)在此配制过程中,下列情况会使配制结果偏高的是____ (填序号)。
①转移时未洗涤烧杯和玻璃棒 ②定容时俯视刻度线观察液面
③定容时仰视刻度线观察液面 ④容量瓶用蒸馏水洗干净后未干燥
⑤摇匀后静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(5)检验食盐中是否加碘,可利用如下反应:KIO3+KI+H2SO4─ K2SO4+I2+H2O(未配平)
①配平该方程式,并且用双线桥法表示该方程式电子转移的方向和数目:___。
②该反应中氧化剂和还原剂的物质的量之比为___。
③如果反应中转移0.5mol电子,则生成I2的物质的量为____mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应的X的同分异构体有(不考虑立体异构)( )
A. 12种B. 13种C. 14种D. 15种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g。则:
(1)混合气体的密度是_______。(结果保留两位小数)
(2)CO和CO2的物质的量之比是________。
(3)CO的体积分数是________,CO的质量分数是________。
(4)混合气体中所含氧原子的物质的量是_________,所含碳原子的物质的量是_________。
(5)混合气体的平均摩尔质量是_________,对氢气的相对密度是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+KNO3+C→K2S+N2↑+CO2↑(未配平)。关于该反应的说法正确的是( )
A.该反应的还原剂S
B.12gC被消耗时,C得到4mol电子
C.该反应中所有元素均有化合价变化
D.有4mol气体生成时,N原子得到10mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的检验,其结论一定正确的是( )
A. 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
B. 向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32-
C. 取少量久置的Na2SO3样品于试管中加水溶解,再加盐酸酸化,然后加BaCl2溶液,若加盐酸有气体产生,加BaCl2有白色沉淀产生。说明Na2SO3样品已部分被氧化
D. 将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知T℃时AgCl的Ksp=2×1010;Ag2CrO4是一种橙红色固体,T℃时在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
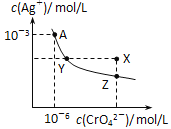
A. T℃时Ag2CrO4的Ksp=1×108
B. Y和Z点Ag2CrO4的Ksp不相同
C. 在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点
D. 浓度均为2×106molL﹣1AgNO3与NaCl溶液等体积混合无沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,二氧化碳作氧化剂的是( )
A.Ca(OH)2+CO2=CaCO3↓+H2O
B.CO2+C![]() 2CO
2CO
C.2Fe2O3+3C![]() 4Fe+3CO2↑
4Fe+3CO2↑
D.C+2H2O(g)![]() 2H2+CO2
2H2+CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com