
| c(Cl 2)c 2(NO) |
| c 4(NO 2) |
| c(Cl 2)c 2(NO) |
| c 4(NO 2) |
| 015mol |
| 0.2mol |


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、乙烯和苯的分子结构均含有碳碳双键 |
B、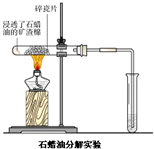 如图石蜡油分解产生的气体只有乙烯,能使溴的CCl4溶液褪色 |
| C、乙烯的产量可以用来衡量一个国家的石油化工生产水平 |
| D、工业常用乙烯与水发生加成反应生产食用酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:
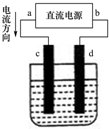
| A、电解过程中,d电极质量增加 |
| B、d为阳极,电极反应为:2Cl--2e-=Cl2↑ |
| C、a为负极、b为正极 |
| D、电解过程中,氯离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
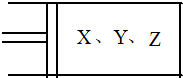 如图所示,将6mol X和3mol Y混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g)?2Z(g).反应达到平衡状态A时,测得气体总物质的量为6.6mol.若X、Y、Z的起始物质的量分别用a.b.c表示,回答下列问题:
如图所示,将6mol X和3mol Y混合气体置于体积可变的等压容器中,在一定温度下发生如下反应:2X(g)+Y(g)?2Z(g).反应达到平衡状态A时,测得气体总物质的量为6.6mol.若X、Y、Z的起始物质的量分别用a.b.c表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9:1 | B、18:7 |
| C、41:9 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl难溶于水,溶液中没有Ag+和Cl- |
| B、AgCl沉淀生成和溶解同时在不断进行,且速率相等 |
| C、向AgCl溶液中加入盐酸,一定会有沉淀生成 |
| D、向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温度、相同质量的N2和CO |
| B、常温常压,同体积的H2O和O2 |
| C、同压强、同物质的量的N2和O2 |
| D、同体积、同密度的N2和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液中滴加过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、CaCO3与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、小苏打治疗胃酸过多:CO32-+2H+=CO2↑+2H2O |
| D、Cu片与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com