
【题目】下列实验操作均要用到玻璃棒,其中作用相同的是( ) ①过滤 ②蒸发 ③溶解 ④向容量瓶中转移液体.
A.①②
B.①②③
C.②③④
D.①④
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述正确的是

A. 甲中△H1=-(△H2+△H3)
B. 乙表示恒温恒容条件下发生的可逆反应2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C. 丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D. 丁表示常温下,稀释HA、HB两种酸的稀溶液时,蒋液pH随加水量的变化,则NaA溶液的pH大于等物质的量浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的是:

A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用SO2水溶液吸收Br2的离子反应方程式为:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
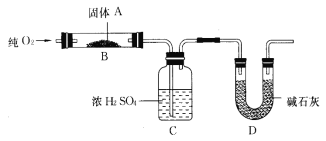
取17.1 g A放入B装置中,持续通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是_______________________________;
(2) D装置的作用是______________________________,有同学认为该套装置有明显的缺陷,需要改进,该同学判断的理由是___________________________;
(3)通过该实验,能否确定A中是否含有氧元素,其理由?_____________________________ ;
(4)若A的摩尔质量为342 g/mol,C装置增重9.9 g,D装置增重26.4 g,则A的分子式为______________________________;
(5)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
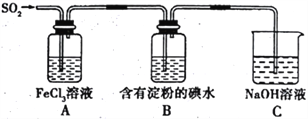
A. 为了验证A 中发生了氧化还原反应,加入稀盐酸酸化的BaCl2溶液,产生白色沉淀
B. 该实验装置至少存在一处设计缺陷
C. 向反应后的A 溶液中加入酸性KMnO4溶液,紫红色褪去,说明一定有Fe2+
D. 装置B是为了验证还原性: SO2>I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动汽车以锂电池提供动力,锂电池技术已经成为汽车研究的前沿科技某锂电池的电池反应为:xLi+Li3-xNiCoMnO6![]() Li3NiCoMnO6,下列说法正确的是
Li3NiCoMnO6,下列说法正确的是![]()
A. 该电池的充、放电过程互为可逆反应
B. 放电时,电池的负极反应为Li-e-=Li+
C. 放电过程中,Li+向电池的负极移动
D. 该电池可以采用醋酸、乙醇等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铈[Ce(OH)4]是一种重要的稀土化合物。以氟碳铈矿(主要含CeFCO3)为原料制备Ce(OH)4的一种工艺流程如下:
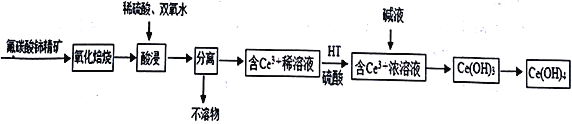
已知:在酸性溶液中Ce4+有强氧化性。回答下列问题:
(1) “氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_________________________,化合物CeFCO3 中Ce 的化合价为________________________。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为__________________________________,酸浸时不宜温度过高的原因是____________________。
(3)已知有机物HT 能将Ce3+从水溶液中萃取出来,该过程可表示为:2 Ce3+ (水层) +6HT (有机层)![]() 2CeT3 (有机层) +6H+ (水层)
2CeT3 (有机层) +6H+ (水层)
从平衡移动角度解释: 向CeT3(有机层) 加入H2SO4获得较纯的含Ce3+的水溶液的原因是____________________。
(4)Ce(OH)3暴露于空气中时变成紫色,最终变成黄色的Ce(OH)4,该反应的化学方程式为________________________________。
(5)已知298 K 时,Ksp[Ce(OH)3]=1×10-20,为了使溶液中Ce3+沉淀完全,需调节pH为______以上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面配制500mL 0.1 mol/L的NaOH溶液的说法正确的是( )
A. 应先用称量纸在托盘天平上称取NaOH固体2g。
B. 定容时若仰视刻度线,会使所配NaOH溶液的浓度偏高。
C. 容量瓶应预先检漏并洗涤干净,但不需干燥,容量瓶中的少量水无影响。
D. 称好的NaOH固体应先放在烧杯中溶解,溶解完全后应立即转移至容量瓶中。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com