
| A. | 100 mL | B. | 200 mL | C. | 300 mL | D. | 400 mL |
分析 金属失去的电子等于氧气与混合气体反应生成硝酸获得的电子,向所得硝酸盐溶液中加入4mol/LNaOH溶液至沉淀最多停止加入,此时溶液为硝酸钠溶液.根据硝酸根守恒可知,钠离子物质的量等于金属失去的电子的物质的量.据此计算NaOH的物质的量,进而计算溶液的体积.
解答 解:标准状况下3.36L氧气的物质的量=$\frac{3.36L}{22.4L/mol}$=0.15mol,所以氧气获得电子的物质的量为0.15mol×4=0.6mol;
金属失去的电子等于氧气与混合气体反应生成硝酸获得的电子,为0.6mol,
向所得硝酸盐溶液中加入2mol/LNaOH溶液至沉淀最多停止加入,此时溶液为硝酸钠溶液.根据硝酸根离子守恒可知,钠离子物质的量等于金属失去的电子的物质的量为0.6mol.则NaOH为0.6mol,所以V(NaOH)=$\frac{0.6mol}{2mol/L}$=0.3L=300mL.
故选:C.
点评 本题考查了氧化还原反应的有关计算,如果利用常规方考虑每个细节的反应将无法解答,根据守恒思想来从总体上分析,再结合转移电子守恒、原子守恒解答,题目难度较大,注意守恒思想的运用.


科目:高中化学 来源: 题型:解答题
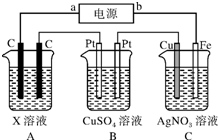 如图所示,电解一段时间后,测得C中Ag+减少了0.1mol,Fe电极被溶解.试回答:
如图所示,电解一段时间后,测得C中Ag+减少了0.1mol,Fe电极被溶解.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
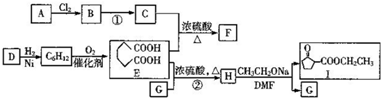
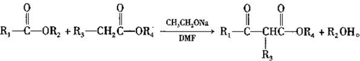
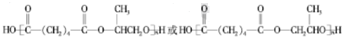 ,1中官能团的名称酯基和羰基.
,1中官能团的名称酯基和羰基.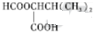 .
.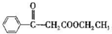 写出合成路线图.
写出合成路线图.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>A | |
| B. | 离子半径:D3+>B2- | |
| C. | 非金属性:A>B | |
| D. | 最高价氧化物对应水化物的碱性:C<D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
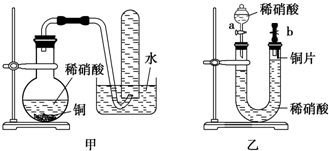
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用双氧水代替高锰酸钾制氧气 | |
| B. | 用多量的氯气进行性质实验 | |
| C. | 用溴水代替碘水进行萃取实验 | |
| D. | 用铜粉代替铜丝进行铜和浓硝酸的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com