
分析 (1)n(CaCO3)=$\frac{1×1{0}^{5}g×0.90}{100g/mol}$=900mol,根据C原子守恒得n(CO2)=n(CaCO3)=900mol,根据V=nVm计算二氧化碳体积;
(2)n(CaCO3)=$\frac{1×1{0}^{5}g×0.90}{100g/mol}$=900mol,根据C原子守恒得碳酸钙生成n(CO2)=n(CaCO3)=900mol,产生的总n(CO2)=$\frac{29120L}{22.4L/mol}$=1300mol,则C生成的二氧化碳物质的量为1300mol-900mol=400mol,根据C原子守恒计算焦炭物质的量;
(3)粗盐水10m3,则该粗盐水中n(MgCl2 )=6.80mol/m3×10m3=68mol,n(CaCl2)=3.00mol/m3×10m3=30mol,根据MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2知氯化镁生成氯化钙物质的量为n(MgCl2 )=n(CaCl2)=68mol,则总的n(CaCl2)=68mol+30mol=98mol,氯化钙和碳酸钠反应时以1:1反应,则需要碳酸钠物质的量为98mol,根据m=nM计算碳酸钠质量;
(4)反应中NH3、CO2按物质的量之比2:1反应,而碳酸化尾气中NH3、CO2的物质的量之比为0.1:0.04=2.5:1,故反应中氨气有剩余,根据钙离子物质的量计算二氧化碳的物质的量,结合二氧化碳的体积分数计算碳酸化尾气的体积.
解答 解:(1)n(CaCO3)=$\frac{1×1{0}^{5}g×0.90}{100g/mol}$=900mol,根据C原子守恒得n(CO2)=n(CaCO3)=900mol,V(CO2)=nVm=900mol×22.4L/mol=20160L,
故答案为:20160;
(2)n(CaCO3)=$\frac{1×1{0}^{5}g×0.90}{100g/mol}$=900mol,根据C原子守恒得碳酸钙生成n(CO2)=n(CaCO3)=900mol,产生的总n(CO2)=$\frac{29120L}{22.4L/mol}$=1300mol,则C生成的二氧化碳物质的量为1300mol-900mol=400mol,根据C原子守恒得n(C)=n(CO2)=400mol,故答案为:400;
(3)粗盐水10m3,则该粗盐水中n(MgCl2 )=6.80mol/m3×10m3=68mol,n(CaCl2)=3.00mol/m3×10m3=30mol,根据MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2知氯化镁生成氯化钙物质的量为n(MgCl2 )=n(CaCl2)=68mol,则总的n(CaCl2)=68mol+30mol=98mol,氯化钙和碳酸钠反应时以1:1反应,则需要碳酸钠物质的量为98mol,m(Na2CO3)=nM=98mol×106g/mol=10388g,故答案为:10388;
(4)加入的碳酸钠除钙离子,溶液中n(Ca2+)=n(Na2CO3)=98mol,反应中NH3、CO2按物质的量之比2:1反应,而碳酸化尾气中NH3、CO2的物质的量之比为0.1:0.04=2.5:1,故反应中氨气有剩余,根据Ca2++2NH3+CO2+H2O→CaCO3↓+2NH4+,可知需要二氧化碳为98mol,故需要碳酸化尾气的体积为98mol×22.4L/mol÷0.04=54880L,
故答案为:54880.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量之间关系是解本题关键,注意原子守恒的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 已知 H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则 H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 葡萄糖的燃烧热是2800 kJ•mol-1,则 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则 2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是 CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1,则 CH3OH(g)的燃烧热为 192.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯 | B. | 玻璃棒 | C. | 容量瓶 | D. | 分液漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 共价键 | N≡N | H-H | N-H |
| 键能(kJ/mol) | 946 | 436 | 390.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸 | B. | 乙醇 | C. | 水 | D. | 乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
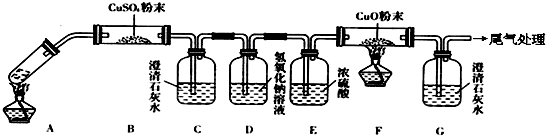
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
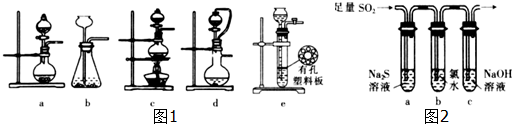
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
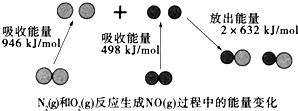
| A. | 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1 | |
| B. | 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ | |
| C. | 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 | |
| D. | 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①④ | B. | 只有②③ | C. | ①②③ | D. | ①②③④都不能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com