
【题目】胶体是一种常见的分散系,回答下列问题.
①向煮沸的蒸馏水中逐滴加入溶液,继续煮沸至 ,
停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为 .
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做 .
③区分胶体和溶液常用的方法叫做 .
【答案】饱和FeCl3;溶液呈红褐色;FeCl3+3H2O(沸水) ![]() Fe(OH)3(胶体)+3HCl;SO42﹣;胶体的聚沉;丁达尔效应
Fe(OH)3(胶体)+3HCl;SO42﹣;胶体的聚沉;丁达尔效应
【解析】解:①Fe(OH)3胶体的制备过程:向煮沸的蒸馏水中逐滴加入FeCl3饱和溶液;继续煮沸至溶液呈红褐色,FeCl3+3H2O(沸水) ![]() Fe(OH)3(胶体)+3HCl,停止加热,可制得Fe(OH)3胶体,
Fe(OH)3(胶体)+3HCl,停止加热,可制得Fe(OH)3胶体,
所以答案是:饱和FeCl3;溶液呈红褐色;FeCl3+3H2O(沸水) ![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于硫酸根离子中和了氢氧化铁胶粒的电荷,导致胶体发生了聚沉,
所以答案是:SO42﹣;胶体的聚沉;
③胶体具有丁达尔效应,据此可以区分胶体和溶液,胶体的丁达尔效应是胶体粒子对光线的散射作用形成的,
所以答案是:丁达尔效应.
【考点精析】根据题目的已知条件,利用胶体的重要性质的相关知识可以得到问题的答案,需要掌握胶体的性质:①丁达尔现象(可用来鉴别胶体和溶液) ②布朗运动 ③电泳现象 ④胶体聚沉(加入电解质、加入带异种电荷的胶体、加热,均可使胶体聚沉).


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为了探究SO2和氯水的漂白性,设计了如图所示实验装置。

(1)写出A中反应的化学方程式:___________, 浓硫酸表现出_____性。
(2)实验室用装置E制备Cl2,离子方程式为____________。该反应中的还原剂是_______(填化学式)。
(3)①装置A和E中,常用于萃取操作的仪器是__________(填名称)。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B.______,D._____。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入品红溶液中,结果发现品红溶液未褪色,并且生成了两种常见的强酸,请你分析该现象的原因:__________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到实验目的是( )
A.用KMnO4溶液鉴别甲烷和乙烯
B.用焰色反应鉴别KNO3和KCl
C.用BaCl2溶液鉴别Na2CO3和Na2SO4
D.用NaOH溶液除去Cl2中含有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72L CH4;②3.01×1023个HCl分子;③7.2gH2O,下列对这三种物质的关系从小到大的排列顺序是:
(1)物质的量;
(2)体积;
(3)质量;
(4)氢原子数 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制的饱和氯水中含有多种做粒,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成。
(1)氯气能使湿润的红色布条褪色,使其褪色的微粒的化学式是__________。
(2)将氯水光照一段时间后,溶液颜色逐渐变浅,有关反应的化学方程式为__________、__________。
(3)新制的饱和氯水与碳酸钙的反应是制取较浓HClO 溶液 的 方 法 之一。
实验一 定性研究:

Ⅰ.如图所示,在试管中加入过量的块状碳酸钙,再加入约20 mL新制的饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去。
Ⅱ.过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强。
Ⅲ.为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体,
将第三份加热,观察到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
①反应后所得的溶液漂白性增强的原因是__________________________________________________。
②依据上述实验可推知:步骤Ⅱ的滤液中的溶质除CaCl2、HClO外,还有__________。
实验二 定量研究:
在仪器A内,放有塑料网包住的块状碳酸钙(过量)和150 mL新制的饱和氯水,按如图所示装置实验(实验前仪器B中充满了饱和NaHCO3溶液),待不再产生气泡后,将塑料网中剩余的碳酸钙提出液面,密封后再加热烧瓶中的液体,直到仪器B中的气体不再增加(不考虑HClO的分解)。

③仪器A的名称为__________。
④准确读出仪器B中气体体积的实验操作步骤依次是:a.等待仪器A冷却到室温;b.____________;c. 平视与刻度线相切的液面读数。
⑤实验结束后,测得仪器B中收集到的气体体积在标准状况下为168mL,则150mL 新制的饱和氯水与过量碳酸钙完全反应后,所得溶液中HClO的物质的量浓度为__________。(反应前后,溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铁粉溶于氯化铁溶液:Fe+2Fe3+═3Fe2+
B.硫化钠溶液呈碱性:S2﹣+2H2OH2S+OH﹣
C.用FeCl3溶液回收废旧电路板中的Cu:Fe3++Cu═Fe2++Cu2+
D.工业上利用电解饱和食盐制氯气:2H++2Cl﹣ ![]() H2↑+Cl2↑
H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的4L密闭容器中,进行可逆反应:X(g)+2Y(g) ![]() 2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图所示.则图中阴影部分面积表示( )
2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图所示.则图中阴影部分面积表示( )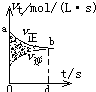
A.X的浓度的减少
B.Y物质的量的减少
C.Z的浓度的增加
D.X物质的量的减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体分子中的极性键在红外线的照射下,易像弹簧一样做伸缩和弯曲运动,从而产生热量而造成温室效应.下列不属于造成温室效应气体的是( )
A.CO2
B.N2O
C.CH4
D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在.
(1)砷与磷为同一主族元素,磷的原子结构示意图为 .
(2)根据元素周期律,下列说法正确的是 .
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3 , 同时生成SO42﹣ , 导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为 .
(4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果: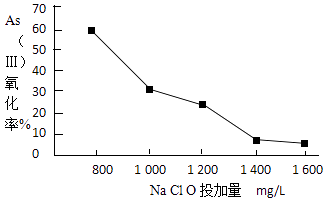
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是 .
(5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的.
已知:一定条件下,As(Ⅴ)的存在形式如表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO3﹣ | HAsO42﹣ | HAsO42﹣、AsO43﹣ |
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com