
| ||
| ||
| ||
| ||
| 11.2L |
| 22.4L/mol |
| 50g |
| 100g |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
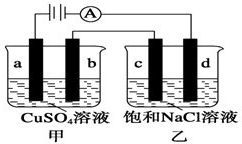 如图a、b、c、d均为石墨电极,通电进行电解(电解液足量).下列说法不正确的是( )
如图a、b、c、d均为石墨电极,通电进行电解(电解液足量).下列说法不正确的是( )| A、甲中a的电极反应式为4OH--4e-═O2↑+2H2O |
| B、向乙中加入适量盐酸,溶液组成可以恢复 |
| C、电解时向乙中滴入酚酞溶液,d电极附近先变红 |
| D、当b极有6.4g Cu析出时,c电极产生7.1g气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
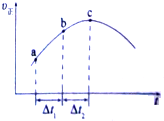 自一个恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示.由此得出结论正确的是( )
自一个恒容密闭容器中通入CO(g)和H2O(g),一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示.由此得出结论正确的是( )| A、反应物浓度:a点小于c点 |
| B、△t1=△t2时氢气的产率:ab段小于bc段 |
| C、该反应的正反应为吸热反应 |
| D、c点反应进行的程度最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 下面是关于药物华素片(西地碘片)使用说明中的部分内容:
下面是关于药物华素片(西地碘片)使用说明中的部分内容:| 华素片(西地碘片)使用说明书 [品名和组成] 品名:西地碘片 商品名:华素片 英文名:Cydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5mg/片.将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等. [贮藏]遮光、密闭、在凉处保存. [有效期]二年 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com