
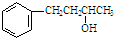 的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )
的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )| A. |  的名称为3-苯基-2-丙醇 的名称为3-苯基-2-丙醇 | |
| B. | 4-苯基-2-丁醇与 互为同系物 互为同系物 | |
| C. | 4-苯基-2-丁醇分子中的所有碳原子一定共平面 | |
| D. | 4-苯基-2-丁醇的核磁共振氢谱共有8个峰 |
分析 A.命名时,编号代数和应符合最小原则;
B.醇、酚为不同类物质;
C.含有饱和碳原子,具有四面体结构;
D.根据H原子的种类判断.
解答 解:A. 应该命名为:1-苯基-2-丙醇,选项中不符合代数和最小原则,故A错误;
应该命名为:1-苯基-2-丙醇,选项中不符合代数和最小原则,故A错误;
B.4-苯基-2-丁醇与苯酚性质不同,不属于同系物,故B错误;
C.4-苯基-2-丁醇分子中存在饱和碳原子,具有四面体结构,故此分子中所有的碳原子不可能共面,故C错误;
D.4-苯基-2-丁醇分子中存在8种不同的H,故有8组峰,故D正确,
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型,注意把握有机物的结构与性质以及原子的共面问题,熟记甲烷、乙烯、乙炔与苯的结构是关键,难度不大.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:解答题
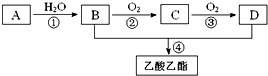
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
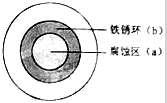 铁及其化合物与生产、生活关系密切,将NaOH溶液滴在一块光亮清洁的铁板表面上,一段时间发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示,请回答下列问题
铁及其化合物与生产、生活关系密切,将NaOH溶液滴在一块光亮清洁的铁板表面上,一段时间发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
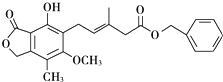
| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 1mol该化合物最多可以与3mol NaOH反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 该有机物与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池放电时,正极的质量会变小 | |
| B. | 对于某耗氧燃料电池.无论负极通入何种燃料,若转移电子总数相等,则正极消耗等质量的氧气 | |
| C. | 可以通过适当的电解装置实现反应2Ag+2H+=2Ag++H2↑ | |
| D. | 电解精炼铜,阳极为粗铜,电镀铜,阳极为纯铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:| A. | T<415℃,只有反应①发生 | |
| B. | 反应①、②不可能同时发生 | |
| C. | 570℃<T<600℃时,残留固体的主要成分是Na2CO3 | |
| D. | 残留固体中的m(Na2C2O4)=m(Na2CO3)时,反应①、②的反应速率相等 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:填空题
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是_______________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是____________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有______________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
实验 混合溶液 | A | B | C | D | E | F |
4mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=_________,V6=________,V9=________。
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com