
分析 (1)工业用电解饱和食盐水的方法制备氯气;
(2)氯气和石灰乳反应生成次氯酸钙、氯化钙;
(3)漂白粉的有效成分是次氯酸钙;
(4)次氯酸钙和水、二氧化碳反应生成HClO;
(5)根据元素化合价是否发生变化判断是否属于氧化还原反应.
解答 解:(1)工业用电解饱和食盐水的方法制备氯气,方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)氯气和石灰乳反应生成次氯酸钙、氯化钙,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)漂白粉的有效成分是次氯酸钙,故答案为:Ca(ClO)2;
(4)次氯酸钙与二氧化碳反应生成次氯酸和碳酸钙,反应的方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O═CaCO3↓+2 HClO;
(5)以上反应中,(1)、(2)中存在元素化合价的变化,属于氧化还原反应,(4)不是氧化还原反应,故答案为:(4).
点评 本题考查漂白粉的制备及漂白原理,把握氯气的性质、次氯酸钙的性质、HClO的性质为解答的关键,明确发生的化学反应即可解答,题目难度不大.


科目:高中化学 来源: 题型:实验题

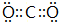 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| B. | 断开化学键的过程会放出能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 酸碱中和反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2、Al2O3、CuO都是碱性氧化物 | |
| B. | 纯碱、烧碱均属碱类 | |
| C. | NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱 | |
| D. | HCl、CH3COOH、HNO3都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: | B. | 丙烷分子的比例模型: | ||
| C. | 1,3-丁二烯的分子式:C4H8 | D. | 甲酸甲酯的结构简式:C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从食盐溶液中获得食盐晶体采用蒸馏的方法 | |
| B. | 将碘晶体中含有的少量沙子除去采用蒸馏的方法 | |
| C. | 除去酒精中含有的较多量水采用蒸馏的方法 | |
| D. | 从碘水中获得碘的晶体采用过滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
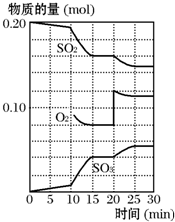 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com