
下列叙述不正确的是( )
A. NH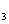 易液化,氨常用作制冷剂 B. 铝盐和铁盐可以用于净水
易液化,氨常用作制冷剂 B. 铝盐和铁盐可以用于净水
C. 与金属反应时,稀HNO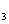 可能被还原为更低价态,则稀HNO
可能被还原为更低价态,则稀HNO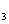 氧化性强于浓HNO
氧化性强于浓HNO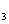
D. 淘金者利用密度的不同,用淘洗的方法将金子从沙里分出来
科目:高中化学 来源: 题型:
CCH3CH3C2H5CHCH3CH3的命名正确的是
A.2-二甲基-3-乙基丁烷
B.2,3,3-三甲基戊烷
C.2,2-二甲基-3-乙基丁烷
D.3,4,4-三甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是
A.碳酸氢钙溶液和氢氧化钠溶液混合:HCO3—+OH—==CO32—+H2O
B.醋酸钠溶液和盐酸混合:CH3COONa+H+ == CH3COOH + Na+
C.少量金属钠放入冷水中:Na+ 2H2O== Na++2OH—+H2↑
D.硫酸铜溶液和氢氧化钡溶液混合:
Cu2+ + SO42— +Ba2+ + 2OH—== Cu(OH)2↓+ BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
A. 金属与酸反应一定放出氢气 B. 含金属元素的离子一定是阳离子
C. 电离生成H+的化合物不一定是酸 D. 金属离子被还原一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
将5.1 g镁和铝投入500 mL 2 mol/L的盐酸中,生成氢气0.5 g,金属完全溶解;再加入
4 mol/L的NaOH溶液,生成沉淀的质量最多是( )
A.22.1 g B.8.5 g C.10.2 g D.13.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
常温常压下,把二氧化碳和一氧化氮的混合气体V mL缓缓通过足量的过氧化钠固体,气体体积缩小到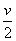 mL,则二氧化碳和一氧化氮的体积比不可能是( )(假设二氧化氮与过氧化钠不反应)A. 2:1 B. 3:2 C. 3:4 D. 5:4
mL,则二氧化碳和一氧化氮的体积比不可能是( )(假设二氧化氮与过氧化钠不反应)A. 2:1 B. 3:2 C. 3:4 D. 5:4
查看答案和解析>>
科目:高中化学 来源: 题型:
关于氮的变化关系图如下:

则下列说法正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线ⅠⅡⅢ是雷电固氮生成硝酸的主要途径
C.上述并不是所有反应都是氧化还原反应
D.上述反应中①②③均属于氮的固定
查看答案和解析>>
科目:高中化学 来源: 题型:
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2 、NO2、O2 乙:MgO、NO2 、O2 丙:Mg3N2、O2 丁:MgO、NO2 、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是 。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
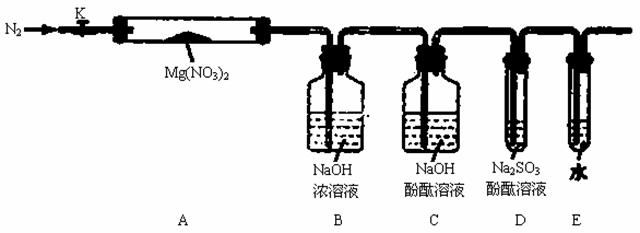
(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明 。
②称取Mg(NO3)2固体3 . 79 g置于A中,加热前通入N2以驱尽装置内的空气,其目是 ;关闭K,用酒精灯加热时,正确操作是先 ,然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1 . 0g
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想 是正确的。
②根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应: (填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是 。(用化学方程式表示)
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①写出该反应的离子方程式_________________________;
②下列收集Cl2的装置正确装置是_________________________;
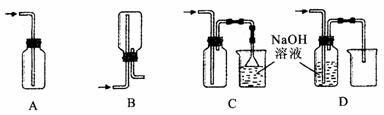
③将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是________________________;
④设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,____________
_______________________________________________________________________________________。
(2)某化学兴趣小组为了探究AgNO3的热稳定性,设计了如下实验。
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
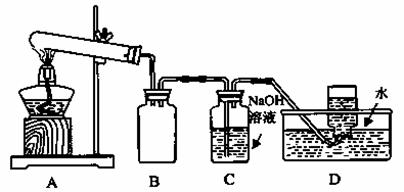
①装置B的作用是___________________________。
②经小组讨论并验证该无色气体为O2,其验证方法是_____________________。
【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:i Ag;ii Ag2O;iii Ag和Ag2O
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
【实验评价】根据上述实验,不能确定固体产物成分的实验是___________(填实验编号)。
【实验结论】根据上述实验结果,该小组得出的AgNO3固体热分解的化学方程式为
④______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com