
| A. | 0.4mol | B. | 0.2mol | C. | 0.2mol<x<0.4mol | D. | <0.2mol |
分析 达平衡后移走1.5mol PCl3 和0.75mol Cl2,重新到达的平衡,可以等效为开始加入1.5mol PCl3 和0.75mol Cl2到达的平衡,与原平衡相比压强减小,平衡向逆反应移动,反应物的转化率减小,故平衡时PC15的物质的量小于原平衡的$\frac{1}{2}$倍.
解答 解:达平衡后移走1.5mol PCl3 和0.75mol Cl2,重新到达的平衡,可以等效为开始加入1.5mol PCl3 和0.75mol Cl2到达的平衡,与原平衡相比压强减小,平衡向逆反应移动,反应物的转化率减小,故平衡时PC15的物质的量小于原平衡的$\frac{1}{2}$倍,即达平衡时PC15的物质的量小于0.4mol×$\frac{1}{2}$=0.2mol,
故选D.
点评 本题考查化学平衡的移动、化学平衡的建立等,难度中等,关键是设计等效平衡建立的途径.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
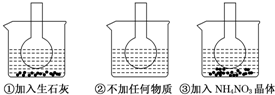
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
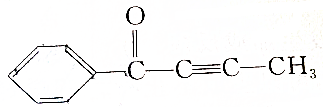 ,请回答下列问题:
,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a(A)>a′(A) a(B)<a′(B) | B. | a(A)>a′(A) a(B)=a′(B) | C. | a(A)<a′(A) a(B)<a′(B) | D. | a(A)=a′(A) a(B)>a′(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是用于合成药物的中间体.请根据下列转化关系图回答有关问题:
)是用于合成药物的中间体.请根据下列转化关系图回答有关问题:
 .
. .
. )是对甲基苯甲酸乙酯的同分异构体,下列物质与其能发生反应的是ACD(填序号).
)是对甲基苯甲酸乙酯的同分异构体,下列物质与其能发生反应的是ACD(填序号). +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
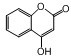 是一种医学中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医学中间体,常用来制备抗凝血药,可通过下列路线合成:
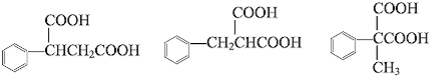 中的任意一种.
中的任意一种.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com