
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子的物质的量为
( )
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
科目:高中化学 来源: 题型:
把SO2通入Fe(NO3)3溶液中,溶液由黄色变为浅绿色,但立即又变为黄色,此时若滴入BaCl2溶液,则会产生白色沉淀.在上述一系列变化过程中,最终被还原的是 ( )
A.SO2 B.NO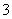 C.Fe3+ D.Fe2+
C.Fe3+ D.Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
关于工业合成氨的叙述中,错误的是( )
A.在动力、设备、材料允许的情况下,反应尽可能在高压下进行
B.温度越高越有利于工业合成氨
C.在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本
D.及时从反应体系中分离出氨气有利于平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积
B.溶度积常数是不受任何条件影响的常数,简称溶度积
C.可用浓度商Qc判断沉淀溶解平衡进行的方向
D.所有物质的溶度积都是随温度的升高而增大的
查看答案和解析>>
科目:高中化学 来源: 题型:
与[H+]·[OH-]=KW类似,FeS饱和溶液中存在:FeS(s)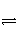
 Fe2+(aq)+S2-(aq),[Fe2+]·[S2-]=Ksp。常温下Ksp=8.1×10-17 mol2·L-2。
Fe2+(aq)+S2-(aq),[Fe2+]·[S2-]=Ksp。常温下Ksp=8.1×10-17 mol2·L-2。
(1)理论上FeS的溶解度为________________,而事实上其溶解度远大于这个数值,其原因可能是________________________________________________________________________
________________________________________________________________________。
(2)又知FeS饱和溶液中[H+]与[S2-]之间存在以下限量关系:[H+]2·[S2-]=1.0×10-22 mol3·L-3,为了使溶液中[Fe2+]达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的[H+]为________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
电解84.75 mL 16%的NaOH溶液(ρ=1.18 g·cm-3),用石墨作电极经过一段时间后溶液浓度为19.5%,这是因为( )
A.溶质增加了3.5 g
B.放出了22.4 L H2和11.2 L O2
C.NaOH比水消耗少
D.消耗18 g水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于铜电极的叙述不正确的是( )
A.在镀件上镀铜时镀件作阴极
B.在镀件上镀铜时可用金属铜作阳极
C.用电解法精炼粗铜时粗铜作阳极
D.用电解法精炼粗铜时纯铜作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在溶液中能大量共存的是( )
A.Ca2+、HCO 、Cl-、K+
、Cl-、K+
B.Al3+、[Al(OH)4]-、HCO 、Na+
、Na+
C.Fe2+、H+、SO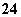 、S2-
、S2-
D.Fe3+、SCN-、Na+、CO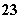
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,对于反应N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
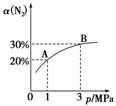
A.将1 mol N2、3 mol H2置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强(减小体积),H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com