
分析 已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,Cl元素的化合价由+3价降低为-1价,由+3价升高为+4价,结合电子、电荷守恒分析.
解答 解:酸性条件下NaClO2可以发生反应生成NaCl并释放出ClO2,生成NaCl时Cl元素的化合价由+3价降低为-1价,化合价降低4价,生成ClO2时Cl元素由+3价升高为+4价,化合价升高1价,则化合价变化的最小公倍数为4,结合电子、电荷守恒可知该反应的离子方程式为:5ClO2-+4H+═4ClO2↑+Cl-+2H2O,
故答案为:5ClO2-+4H+═4ClO2↑+Cl-+2H2O.
点评 本题考查氧化还原反应型的离子配平,题目难度中等,明确离子方程式的书写原则为解答关键,注意掌握守恒思想在配平氧化还原反应中的应用,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的电子式: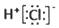 | |
| B. | 质子数为6,中子数为8的核素:${\;}_{6}^{14}$C | |
| C. | Na+的结构示意图: | |
| D. | CH4分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
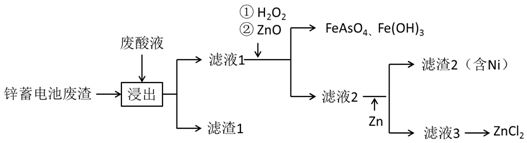
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
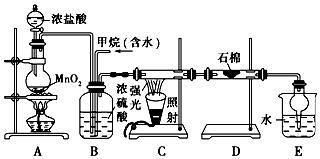
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Cl-、Na+ | B. | MnO4-、Ca2+、NO3-、Cl- | ||
| C. | HSO3-、HCO3-、NO3-、SO32- | D. | Na+、Ca2+、NO3-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10mL3.4mol•L-1的FeCl3溶液滴入沸水中制成Fe(OH)3胶体,所得体系中胶粒的数目小于0.034NA | |
| B. | 3.6gH2O与19.6g浓硫酸所含分子数均为0.2NA | |
| C. | I7.4g MnO2与40mL 10mol•L-1浓盐酸反应,转移电于的数目为0.2NA | |
| D. | 常温下pH=4的醋酸溶液中由水电离出的H+的数目为10-10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 托盘天平、烧杯、容量瓶、玻璃棒 | |
| B. | 烧杯、玻璃棒、胶头滴管、量筒 | |
| C. | 烧杯、容量瓶、玻璃棒、胶头滴管 | |
| D. | 烧杯、容量瓶、玻璃棒、胶头滴管、量筒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①④⑤ | C. | ②③④⑤ | D. | ①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com