
£Ø1£©ŅŌĻĀ·“Ó¦£Ø»ņ¹ż³Ģ£©£ŗ¢ŁĻõĖįļ§¾§ĢåČÜÓŚĖ® ¢ŚČ¼ÉÕĢģČ»Ęų ¢ŪÉśŹÆ»ŅÓėĖ®·“Ó¦
¢ÜĻ”ŃĪĖįÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦ ¢ŻBa(OH)2”¤8H2OÓėĀČ»Æļ§¾§Ģå·“Ó¦ ¢ŽŠæĮ£ŗĶĻ”ĮņĖį»ģŗĻ£¬
ĘäÖŠŹōÓŚ·ÅČČ·“Ó¦£Ø»ņ¹ż³Ģ£©µÄŹĒ £ØĢīŠņŗÅ£©£¬Š“³öĪüČČ·“Ó¦µÄ»Æѧ·½³ĢŹ½
 ӣ
ӣ
£Ø2£©ŅŌ·“Ó¦2Fe3+ + Cu£½2Fe2++ Cu2+ĪŖŌĄķÉč¼ĘŅ»øöŌµē³Ų£¬
ŌŚ·½æņÖŠ»³öŌµē³ŲµÄŹ¾ŅāĶ¼£ØŌŚĶ¼ÉĻ±ź³öĮ½¼«²ÄĮĻ”¢
Õżøŗ¼«”¢µē½āÖŹČÜŅŗŗĶµē×ÓĮ÷Ļņ£©”£
£Ø3£©ÓƵŖ»Æ¹č(Si3N4)ĢÕ“É“śĢę½šŹōÖĘŌģ·¢¶Æ»śµÄÄĶČČ²æ¼ž£¬
Äܓ󷳶ČĢįøß·¢¶Æ»śµÄČČŠ§ĀŹ”£¹¤ŅµÉĻÓĆ»ÆѧĘųĻą³Į»ż·ØÖʱøµŖ»Æ¹č£¬Ęä·“Ó¦ČēĻĀ£ŗ
3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4 (s)+12HCl(g)£¬Ņ»¶ØĢõ¼žĻĀ£¬ŌŚĆܱÕŗćČŻµÄČŻĘ÷ÖŠ£¬±ķŹ¾
Si3N4 (s)+12HCl(g)£¬Ņ»¶ØĢõ¼žĻĀ£¬ŌŚĆܱÕŗćČŻµÄČŻĘ÷ÖŠ£¬±ķŹ¾
ÉĻŹö·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ ”£
¢Ł3¦ŌÄę(N2)£½¦ŌÕż(H2) ¢Ś¦ŌÄę(HCl)£½4¦ŌÕż(SiCl4) ¢Ū»ģŗĻĘųĢåµÄĆܶȱ£³Ö²»±ä
¢Üc(N2): c(H2): c(HCl)£½1:3:6
 ¢ŁÄÄŅ»Ź±¼ä¶Ī£ØÖø0”«1”¢1”«2”¢2”«3”¢3”«4”¢4”«5min£©·“Ó¦ĖŁĀŹ×ī“ó £¬ŌŅņŹĒøĆ·“Ó¦ŹĒ ”£
¢ŁÄÄŅ»Ź±¼ä¶Ī£ØÖø0”«1”¢1”«2”¢2”«3”¢3”«4”¢4”«5min£©·“Ó¦ĖŁĀŹ×ī“ó £¬ŌŅņŹĒøĆ·“Ó¦ŹĒ ”£
¢ŚÄÄŅ»Ź±¶ĪµÄ·“Ó¦ĖŁĀŹ×īŠ” £¬ŌŅņŹĒ ”£
 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā


| ||
| ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| HA | H2B | HC | ||
| Ka | Ka1 | Ka2 | Ka | |
| ŹżÖµ | 1.8”Į10-5 | 4.3”Į10-7 | 5.6”Į10-11 5.6”Į10-11 |
4.9”Į10-10 4.9”Į10-10 |
 £Ø3£©ČēĶ¼ŹĒijĖ®ČÜŅŗŌŚpH“Ó0ÖĮ14µÄ·¶Ī§ÄŚH2CO3”¢HCO3-”¢CO32-ČżÖֳɷÖĘ½ŗāŹ±µÄ×é³É·ÖŹż£®
£Ø3£©ČēĶ¼ŹĒijĖ®ČÜŅŗŌŚpH“Ó0ÖĮ14µÄ·¶Ī§ÄŚH2CO3”¢HCO3-”¢CO32-ČżÖֳɷÖĘ½ŗāŹ±µÄ×é³É·ÖŹż£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
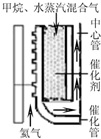 £Ø2010?½ĖÕ¶žÄ££©ŅŌĢģČ»ĘųĪŖŌĮĻ¾ÓÉŗĻ³ÉĘų£ØCO”¢H2£©ÖĘ»ÆѧʷŹĒÄæĒ°ĢģČ»Ęų×Ŗ»ÆĄūÓƵÄÖ÷µ¼¼¼ŹõĀ·Ļߣ¬Ö÷ŅŖ¹¤ŅÕÓŠŅŌĻĀ¼øÖÖ£ŗ
£Ø2010?½ĖÕ¶žÄ££©ŅŌĢģČ»ĘųĪŖŌĮĻ¾ÓÉŗĻ³ÉĘų£ØCO”¢H2£©ÖĘ»ÆѧʷŹĒÄæĒ°ĢģČ»Ęų×Ŗ»ÆĄūÓƵÄÖ÷µ¼¼¼ŹõĀ·Ļߣ¬Ö÷ŅŖ¹¤ŅÕÓŠŅŌĻĀ¼øÖÖ£ŗ| 1 |
| 2 |
| ĘųĢå | ½ųæŚĪĀ¶Č/”ę | ½ųæŚŃ¹Ēæ/MPa | ½ųæŚĮ÷Įæ/g?s-1 | ³öæŚĮ÷Įæ/g?s-1 |
| ¼×Ķé | 464 | 4.26 | 12 | 5.4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
 ”±±źÖ¾µÄŹĒ
”±±źÖ¾µÄŹĒ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
[»Æѧ”Ŗ”Ŗ»ÆѧÓėÉś»ī]
ĻĀĮŠÄŚČŻ¶¼ÓėČĖĆĒµÄÉś»īŗĶ½”æµĆÜĒŠĻą¹Ų£¬Ēėøł¾ŻŅŖĒóĢīæÕ£ŗ
£Ø1£©Ń§ÉśŅŖ×¢ŅāŗĻĄķÉÅŹ³£¬×¢ŅāŹ³Ę·µÄ¶ąŃł»Æ£¬·ĄÖ¹Ä³ÖÖÓŖŃų³É·Ö¹ż¶ą»ņ¹żÉŁ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢Ł“óĆ×µÄÖ÷ŅŖ³É·ÖŌŚČĖĢåÄŚ×īÖÕ±ä³ÉĮĖ £ØĢīĆū³Ę£©¶ų±»ČĖĢåĪüŹÕ”£
¢Ś»µŃŖ²”ŹĒÓÉӌȱ·¦Ī¬ÉśĖŲC¶ųŅżĘšµÄ£¬ĻĀĮŠÓŠ¹ŲĪ¬ÉśĖŲCµÄĖµ·ØÕżČ·µÄŹĒ ”£
A£®Ī¬ÉśĖŲCŹĒÖ¬ČÜŠŌĪ¬ÉśĖŲ£¬Ņ×ŌŚĢåÄŚ»ż“ę
B£®Ī¬ÉśĖŲCæÉ×÷Ź³Ę·Ģķ¼Ó¼Į
C£®Ī¬ÉśĖŲCĖäČ»±»³ĘĪŖæ¹»µŃŖĖį£¬µ«![]() ĖüµÄĖ®ČÜŅŗ²¢²»³ŹĖįŠŌ
ĖüµÄĖ®ČÜŅŗ²¢²»³ŹĖįŠŌ
![]() D£®Ī¬ÉśĖŲCŌŚĖ®ČÜŅŗÖŠ»ņŹÜČČŹ±ŗÜČŻŅ×±»Ńõ»Æ£¬ĖłŅŌÉś³ŌŠĀĻŹŹß²ĖŅŖ±ČŹģ³ŌŹ±Ī¬ÉśĖŲCµÄĖšŹ§ÉŁ
D£®Ī¬ÉśĖŲCŌŚĖ®ČÜŅŗÖŠ»ņŹÜČČŹ±ŗÜČŻŅ×±»Ńõ»Æ£¬ĖłŅŌÉś³ŌŠĀĻŹŹß²ĖŅŖ±ČŹģ³ŌŹ±Ī¬ÉśĖŲCµÄĖšŹ§ÉŁ
¢ŪŹß²Ė”¢Ė®¹ūÖŠĪ¬ÉśĖŲCµÄŗ¬Įæ½Ļøߣ¬Č±·¦Ī¬ÉśĖŲCµÄĶ¬Ń§ŌŚÉÅŹ³ÖŠÓ¦øĆŌö¼ÓŹß²Ė”¢Ė®¹ūµÄÉćČėĮ棬Šķ¶ąŹß²Ė”¢Ė®¹ū£ØČēÄūĆŹĖįµČ£©ŹĒ £ØĢī”°ĖįŠŌŹ³Īļ”±»ņ”°¼īŠŌŹ³Īļ”±£©”£
£Ø2£©ĻĀ±ķŹĒĪŅ¹ś²æ·Ö³ĒŹŠæÕĘųÖŹĮæÖܱأ¬ŌĶĮ²¢»Ų“šĻĀĮŠĪŹĢā£ŗ
| ³ĒŹŠ | ĪŪČ¾ ÖøŹż | Ź×ŅŖ ĪŪČ¾Īļ | æÕĘųÖŹĮ漶±š | ³ĒŹŠ | ĪŪČ¾ ÖøŹż | Ź×ŅŖ[Ą“Ō“:Zxxk.Com] ĪŪČ¾Īļ | æÕĘųÖŹĮ漶±š |
| ±±¾© | 92 | TSP | II | ¼ĆÄĻ | 76 | TSP | II |
| Ģģ½ņ | 82 | TSP | II | Īäŗŗ | 83 | NOx | II |
| ¹ž¶ū±õ | 96 | TSP | II | ÖŲĒģ | 98 | SOx | II |
| ÉĻŗ£ | 74 | NOx | II | ³¤É³ | 61 | TSP | II |
| ×¢£ŗTSP”Ŗ”ŖæÕĘųÖŠµÄĘ®³¾ | |||||||
¢Ł×īČŻŅ׳öĻÖĖįÓźµÄ³ĒŹŠŹĒ______£»ĪŖ¼õÉŁ³ĒŹŠĖįÓźµÄ²śÉś£¬æɲÉČ”ŅŌĻĀ“ėŹ©ÖŠµÄ ”£
A£®½ūÖ¹ÓĆĆŗ×÷Č¼ĮĻ
B£®øÄÉĘČ¼ĆŗÖŹĮ棬ĻŽÖĘøßĮņĆŗĢæµÄæŖ²É
C£®ĻņŅŃĖį»ÆµÄĶĮČĄÖŠ¼ÓŹÆ»Ņ
D£®µ÷ÕūŗĶÓÅ»ÆÄÜŌ“½į¹¹£¬¼ÓæģæŖ·¢ŗĶĄūÓĆŠĀÄÜŌ“”£
¢ŚĘū³µĪ²Ęų£Øŗ¬ÓŠCO”¢SO2ÓėNOµČĪļÖŹ£©ŹĒ³ĒŹŠæÕĘųµÄĪŪČ¾Īļ£¬ÖĪĄķµÄ·½·ØÖ®Ņ»ŹĒŌŚĘū³µµÄÅÅĘų¹ÜÉĻ×°Ņ»øö“ß»Æ×Ŗ»»Ę÷£¬ĘäĢŲµćŹĒŹ¹COÓėNO·“Ó¦£¬Éś³ÉæɲĪÓė“óĘųÉśĢ¬»·¾³Ń»·µÄĪŽ¶¾ĘųĢ壬Š“³öCOÓėNO·“Ó¦µÄ»Æѧ·½³ĢŹ½____________________________________________________________”£
£Ø3£©Ė®ŹĒÉśĆüÖ®Ō“£¬¶ÆÖ²ĪļµÄÉśĆü»ī¶ÆÓėĘäĆÜĒŠĻą¹Ų£¬»Ų“šĻĀĮŠĪŹĢā£ŗ?
¢Ł¹¤Ņµ·ĻĖ®ÖŠ³£ŗ¬ÓŠ²»Ķ¬ĄąŠĶµÄĪŪČ¾Īļ£¬æɲÉÓĆ²»Ķ¬µÄ·½·Ø“¦Ąķ”£ŅŌĻĀ“¦Ąķ“ėŹ©ŗĶ·½·ØÕżČ·µÄŹĒ ”£
| Ń”Ļī | ĪŪČ¾Īļ | “¦Ąķ“ėŹ© | ·½·ØĄą±š |
| A | ·ĻĖį | ¼ÓĒāŃõ»ÆÄĘÖŠŗĶ | ÖŠŗĶ·Ø |
| B | Cu2+µČÖŲ½šŹōĄė×Ó | ¼ÓĮņĖįŃĪ³Į½µ | ³Įµķ·Ø |
| C | ŗ¬±½·ĻĖ® | ÓĆ»īŠŌĢæĪüø½ | ĪļĄķ·Ø |
| D | Šüø”Īļ | ¼ÓĆ÷·Æ | »ģÄż·Ø |
![]() ¢ŚĪŅŹ”Ļę½Į÷Óņ¹¤³§½Ļ¶ą£¬Čē¹ūĪŪĖ®“¦Ąķ²»µ±£¬ČŻŅ×Ōģ³É¹¤ŅµĪŪČ¾”£ĪŅ¹ś¹¤Ņµ·ĻĖ®ÖŠ¼øÖÖĪŪČ¾ĪļµÄ×īøßŌŹŠķÅÅ·ÅÅضČČēĻĀ±ķ£ŗ
¢ŚĪŅŹ”Ļę½Į÷Óņ¹¤³§½Ļ¶ą£¬Čē¹ūĪŪĖ®“¦Ąķ²»µ±£¬ČŻŅ×Ōģ³É¹¤ŅµĪŪČ¾”£ĪŅ¹ś¹¤Ņµ·ĻĖ®ÖŠ¼øÖÖĪŪČ¾ĪļµÄ×īøßŌŹŠķÅÅ·ÅÅضČČēĻĀ±ķ£ŗ
| ĪŪČ¾Īļ | ¹Æ | ļÓ | Ē¦ |
| Ö÷ŅŖ“ęŌŚŠĪŹ½ | Hg2+ | Cd2+ | Pb2+ |
| ×īøßŌŹŠķÅÅ·ÅÅضČ/£Ømg”¤dm£3£© | 0£®05 | 0£®1 | 1£®0 |
ĻÖӊij¹¤³§ĆæČÕÅŷŵÄĪŪĖ®ÖŠ¹ÆµÄÖŹĮæ·ÖŹżĪŖ£Ø1”Į10£6£©%£¬ļÓµÄÖŹĮæ·ÖŹżĪŖ£Ø2”Į10£5£©%£¬Ē¦µÄÖŹĮæ·ÖŹżĪŖ£Ø5”Į10£5£©%£ØÉčøĆĪŪĖ®µÄĆܶČĪŖ1 g/cm3£©”£øł¾Ż¼ĘĖćøĆ³§ČżĻīĪŪČ¾ĪļÖŠ ³¬±ź”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com