
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | M | N |
分析 由元素在周期表中位置可知:A为H元素、B为C元素、C为N元素、D为F元素、E为He元素、F为Na元素、G为Mg元素、H为Al元素、I为Si元素、J为P元素、K为S元素、M为Cl元素、N为Ar元素,
(1)以上各元素中,非金属性最强的为F,形成单质氧化性正确的为氟气;还原性最强的单质为金属钠;
(2)非金属性越强,最高价氧化物的水化物酸性越强,F没有最高价,则最高价氧化物对应水化物酸性最强的为Cl元素;最高价氧化物对应的水化物呈两性的氢氧化铝,
(3)原子的电子层越多,原子半径越大,电子层相同时,原子的核电荷数越大,原子半径越小,据此判断该原子半径大小;
(4)离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,据此比较各离子半径大小;
(5)F的最高价氧化物对应的水化物为氢氧化钠,H的最高价氧化物对应的水化物为氢氧化铝,二者反应生成偏铝酸钠和水.
解答 解:由元素在周期表中位置可知:A为H元素、B为C元素、C为N元素、D为F元素、E为He元素、F为Na元素、G为Mg元素、H为Al元素、I为Si元素、J为P元素、K为S元素、M为Cl元素、N为Ar元素,
(1)以上各元素中,非金属性最强的为F,形成单质氧化性正确的为F2;还原性最强的单质为Na,
故答案为:F2;Na;
(2)非金属性越强,最高价氧化物的水化物酸性越强,则酸性最强的为高氯酸;最高价氧化物对应的水化物呈两性的氢氧化铝,
故答案为:高氯酸;氢氧化铝;
(3)原子的电子层越多,原子半径越大,电子层相同时,原子的核电荷数越大,原子半径越小,则各原子的原子半径大小为:Na>Mg>Al>C>N>F,
故答案为:Na>Mg>Al>C>N>F;
(4)离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小,则各离子半径大小为:Cl->F->Na+,
故答案为:Cl->F->Na+;
(5)F的最高价氧化物对应的水化物为氢氧化钠,H的最高价氧化物对应的水化物为氢氧化铝,氢氧化铝与氢氧化铝反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查了元素周期表与元素周期律的综合应用,题目难度中等,熟练掌握元素周期表结构、元素周期律的内容为解答关键,注意明确粒子比较与电子层数、核电荷数为关系,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
 A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).
A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 信息产业中的光缆的主要成份是单质硅 | |
| B. | NO2、CO2、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
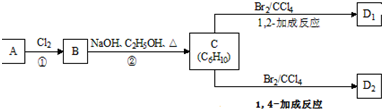
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Hm+2bXOb | B. | Hm-2bXOb | C. | Hb+mXOb | D. | H2b-mXOb |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | △H1<△H2 | |
| B. | 若反应HCO3-+H+=CO2↑+H2O的熵增效应大于吸热效应,则其在常温常下能自发进行 | |
| C. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2-△H3) kJ/mol | |
| D. | 相同条件下,结合H+的能力:CO32->HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
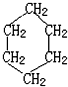 是环己烷的结构简式,下列说法不正确的是( )
是环己烷的结构简式,下列说法不正确的是( )| A. | 环己烷不属于烃 | |
| B. | 环己烷的分子式为C6H12 | |
| C. | 环己烷是苯和氢气加成产物 | |
| D. | 1 mol环己烷完全燃烧消耗氧气的物质的量为9 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,CS2的晶体类型为分子 晶体;
,CS2的晶体类型为分子 晶体;| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com