
(10分)某铝合金中含铜、锌、铝和硅。现取1.000g铝合金与足量盐酸反应,生成843mL H2(0℃,101.325 kPa下),未溶物为0.170g。再称取0.500g铝合金与足量NaOH溶液反应,生成517mL H2(0℃,101.325 kPa下),仍有部分固体未溶。计算此合金中各组分的百分含量。(需写出相应的反应方程式,有效数字有一个错,扣掉有效数字分2分)。
铝合金与HCl反应时,只有锌和铝反应生成H2,
铝合金与NaOH反应时,只有锌、铝和硅反应生成H2
1.000g铝合金与HCl反应,生成![]() =
=![]() =0.0376 (mol) (1分)
=0.0376 (mol) (1分)
1.000g铝合金与NaOH反应,生成![]() =
=![]() =0.0462 (mol) (1分)
=0.0462 (mol) (1分)
两者之差,![]() =
=![]() -
-![]() =0.0462-0.0376=0.0086(mol) (1分)
=0.0462-0.0376=0.0086(mol) (1分)
![]() 乃是硅与NaOH反应生成的H2,
乃是硅与NaOH反应生成的H2,
Si+4NaOH=Na4SiO4+2H2
∴ ![]() :
:![]() =
=![]() :0.0086=1:2,
:0.0086=1:2, ![]() =0.0086/2=0.0043(mol) (2分
=0.0086/2=0.0043(mol) (2分
![]() =28.09×0.0043=0.12(g) 含Si%=12%
=28.09×0.0043=0.12(g) 含Si%=12%
![]() =0.170-0.12=0.05(g) 含Cu%=5% (2分)
=0.170-0.12=0.05(g) 含Cu%=5% (2分)
2Al+6HCl=2AlCl3+3H2 Zn+2HCl=ZnCl2+H2
设Al的质量为x g,则Zn为:1.000-0.170-x
![]() =0.0376
=0.0376
x=0.618g, 含Al%=61.8%
![]() =0.830-0.618=0.212(g) 含Zn%=21.2% (3分)
=0.830-0.618=0.212(g) 含Zn%=21.2% (3分)
(其它合理解法可给分)


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:阅读理解
| 高温 |
| 4100a |
| 22.4w |
| 4100a |
| 22.4w |
查看答案和解析>>
科目:高中化学 来源:江山市模拟 题型:填空题
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(温州市十校联合体高三联考)2007年国家质检总局铝合金抽检合格率约为90%。已知国家行业标准中铸造铝合金的各成分的质量分数为:Si-4.5%~5.5%,Cu-1.0%~1.5%,Mg-0.4%~0.6%,其余为Al。
现对某品牌的铸造铝合金中所含的四种成分作如下的实验检测:
①称取18.0g铸造铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。(已知:Si+2NaOH+H2O=Na2SiO3+2H2↑)
②待两份反应物都充分反应之后,称得滤渣质量相差0.512g,收集得到的两份气体的体积相差851.2mL(标准状况下)。
试回答下列问题:
⑴样品中Si和Mg的物质的量分别是多少。
⑵通过计算判断该品牌的铸造铝合金是否为合格产品(一项不达标即为不合格产品)
查看答案和解析>>
科目:高中化学 来源:2011年浙江省衢州市江山市高考化学模拟试卷(解析版) 题型:填空题
 2AlN+3CO
2AlN+3CO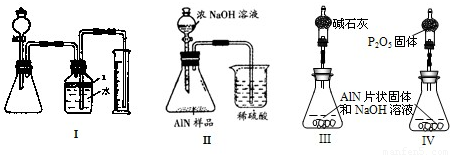
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com