
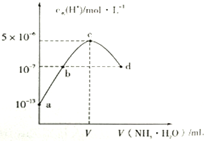
 常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | V=40 | |
| B. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3.H2O) | |
| C. | NH3.H2O的电离常数K=10-4 | |
| D. | d点所示溶液中:c(NH4+)═2c(SO42-) |
分析 
A.c点水电离程度最大,说明此时铵根离子浓度最大,对水的电离促进程度最大;
B.根据质子守恒分析解答;
C.根据40mL时溶液pH计算出氢离子、氢氧根离子浓度,然后结合物料守恒计算出一水合氨浓度,然后根据Ka=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算;
D.根据电荷守恒结合溶液呈中性分析解答.
解答 解:A.c点水电离程度最大,说明此时铵根离子浓度最大,对水的电离促进程度最大,所以两者恰好完全反应生成硫酸铵,而稀硫酸的浓度为0.05mol/L,所以氨水的体积也是20ml,即V=20,故A错误;
B.c点所示溶液是硫酸铵溶液,溶液中质子守恒:c(H+)=c(NH3.H2O)+c(OH-),所以溶液中存在:c(H+)-c(OH-)=c(NH3.H2O),故B错误;
C.加入20mL氨水时两溶液恰好反应,此时c(H+)=5×10-6mol/L,c(OH-)=$\frac{1{0}^{-14}}{5×1{0}^{-6}}$=2×10-9mol/L,由于溶液中氢离子主要是铵根离子水解生成的,则c(NH3.H2O)≈c(H+)=5×10-6mol/L,铵根离子水解程度较小,则c(NH4+)≈0.05mol/L,所以常温下0.1mol/L的氨水的Ka=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.05×2×1{0}^{-9}}{5×1{0}^{-6}}$=2×10-5,故C错误;
D.根据电荷守恒:c(H+)+c(NH4+)=2c(SO42-)+c(OH-),而溶液呈中性c(OH-)=c(H+),所以c(NH4+)=2c(SO42-),故D正确;
故选D.
点评 本题考查混合溶液的酸碱性判断,侧重考查学生分析判断及识图能力,题目难度中等,明确图中曲线变化趋势及每一点溶液中溶质成分及其性质是解本题关键,注意电荷守恒的灵活运用.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:实验题
 尿素[CO(NH2)2]是首个由无机物人工合成的有机物
尿素[CO(NH2)2]是首个由无机物人工合成的有机物查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林(C9H8O4) | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氯气与足量的铜充分反应 | B. | 0.2mol浓硫酸与足量铜反应 | ||
| C. | 46g金属钠与足量的水反应 | D. | 56g铁与足量稀硝酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酒精在氧气中燃烧 | B. | 在硫酸中加入铝粉 | ||
| C. | 将二氧化碳气体通入烧碱中 | D. | 向盐酸中加入铁钉 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将实验完剩余的金属钠放回原试剂瓶中 | |
| B. | 测定熔融氢氧化钠的导电性,可在铁质坩埚中熔化氢氧化钠固体后进行测量 | |
| C. | 制备Fe(OH)3胶体通常是将饱和氯化铁溶液煮沸,直至呈红褐色时停止加热 | |
| D. | 在饱和NaOH溶液中加一定量Na2O2,充分反应后恢复到原温度,有晶体析出,溶液质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为C的氢化物分子内含有氢键,所以比E的氢化物稳定 | |
| B. | 过量F与氯气加热完全反应,得到相应的低价态氯化物 | |
| C. | 因为E单质相对分子量小于溴单质的相对分子量,所以E单质熔点比溴低 | |
| D. | A、D形成化合物的水溶液呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com