
(1)硝化作用;反硝化作用;硝化细菌
(2)N2+O2 2NO;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO;酸雨;叶、芽
2NO;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO;酸雨;叶、芽
(3)会造成水体富营养化,藻类植物过度繁殖,它们死亡后,先被需氧微生物分解,使水中含氧量减少,又被厌氧微生物分解产生H2S、CH4等物质,致使鱼及其他水生生物大量死亡
(4)减少使用氮肥的费用,降低粮食成本;减少氮肥生产,从而节省能源;避免氮肥过多,造成水体富营养化
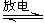 2NO,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO 。可见雷雨天时,该反应过多会造成酸雨的发生,它对陆生植物的叶、芽组织有损害作用。
2NO,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO 。可见雷雨天时,该反应过多会造成酸雨的发生,它对陆生植物的叶、芽组织有损害作用。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
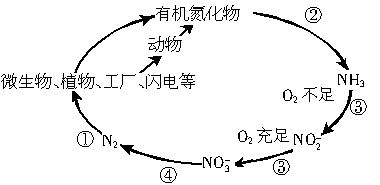
下图是氮元素在自然界中的循环示意图,又知1mol氮气与氧气化合生成2mol NO气体时需吸收180.7kJ热量。试回答:
(1)图中 过程称为氮的固定(填写序号)
(2)下列能将蛋白质转化为氨的生物是 (填写字母)
A.藻类 B.分解者 C.化能合成细菌
(3)若在一次雷雨闪电中两块云间的电势差为109 V,从一块云移到另一块云的电量约为30C,此次闪电放出的能量是 kJ。
(4)若闪电时有千分之一的能量用于生成NO,能产生NO mol。
(5)此次雷雨生成物相当于给大地施加尿素[CO(NH2)2]肥料 kg。
查看答案和解析>>
科目:高中化学 来源:2010年浙江省慈溪中学高二第二学期期中考试(1—3班)化学试题 题型:填空题
(19分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒
2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒
压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
若在固定容积的密闭容器中发生反应,起始时SO2和O2分别为1mol和0.5mol,达到平衡时SO2的转化率为90%。则从SO3开始进行反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量 ,转化率为
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,
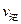 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①写出自然界固氮的化学反应方程式: 。
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时 )
)
查看答案和解析>>
科目:高中化学 来源:2015届广东省高一第一学期期末考试化学试卷B(解析版) 题型:填空题
氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力。下图是自然界中氮的循环图,请回答有关问题。

(1)从空气中获取氮是人类长久以来追求的目标。下列有关说法正确的是_________(填序号)。
a.图中①②③④⑤都属于自然界的固氮过程
b.在过程⑥中,氮元素的化合价降低
c.反应②的化学方程式是N2 +O2
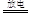 2NO
2NO
d.德国化学家哈伯发明了合成氨工艺,其主要反应如下2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)氨经氧化后可得到硝酸,而硝酸能与氨形成含氮量很高的肥料NH4NO3,施用于土壤而实现非自然形式的氮循环。但这种肥料不适宜与碱性物质共用,否则会降低肥效,其原因是_________________________________(用离子方程式表示)。
(3)人类活动对氮循环产生着明显的影响。汽车尾气中的NO,是造成光化学烟雾的物质之一,但NO对人体又起着独特的生理作用,被誉为“明星分子”,有三位科学家因此项研究成果而获得1998年诺贝尔奖。上述事实说明我们应辨证地看待化学物质的作用。科技人员已经找到了一些解决NO排放的方法。在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体CO跟NO反应转化为空气中的两种成分。气体在催化剂表面吸附与解吸作用的机理如下图所示。
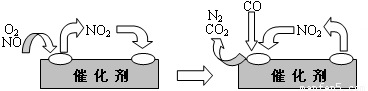
写出上述变化中的总化学反应方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力。下图是自然界中氮的循环图,请回答有关问题。

(1)从空气中获取氮是人类长久以来追求的目标。下列有关说法正确的是_________(填序号)。
a.图中①②③④⑤都属于自然界的固氮过程
b.在过程⑥中,氮元素的化合价降低
c.反应②的化学方程式是N2 + O2 ![]() 2NO
2NO
d.德国化学家哈伯发明了合成氨工艺,其主要反应如下
2 NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)氨经氧化后可得到硝酸,而硝酸能与氨形成含氮量很高的肥料NH4NO3,施用于土壤而实现非自然形式的氮循环。但这种肥料不适宜与碱性物质共用,否则会降低肥效,其原因是_________________________________(用离子方程式表示)。
(3)人类活动对氮循环产生着明显的影响。汽车尾气中的NO,是造成光化学烟雾的物质之一,但NO对人体又起着独特的生理作用,被誉为“明星分子”,有三位科学家因此项研究成果而获得1998年诺贝尔奖。上述事实说明我们应辨证地看待化学物质的作用。
科技人员已经找到了一些解决NO排放的方法。在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体CO跟NO反应转化为空气中的两种成分。气体在催化剂表面吸附与解吸作用的机理如下图所示。

写出上述变化中的总化学反应方程式____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com