
【题目】羚羊角或犀牛角是治疗创伤的中药方剂中用量极少的成分,但是缺少这味药,疗效将大大下降甚至无效。已知动物的角主要由死亡细胞的角化(变性)蛋白质组成,则羚羊角等的有效成分最可能是( )
A. 特殊活性的蛋白质
B. DNA
C. 微量元素
D. 大量元素
科目:高中化学 来源: 题型:
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。
(1)写出NH2Cl的电子式______________。
(2)写出NH2Cl与水反应的化学方程式_____________________。
(3)一定条件下(T℃、latm),可以用Cl2(g)和NH3(g)制得NH2Cl(g) 同时得到HCl(g)。
已知部分化学键的键能如下表:
化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式________________________。
II.亚硝酸氯(NOCl)是有机合成中重要试剂,可由NO与Cl2在一定条件下合成。保持恒温恒容条件,将物质的量之和为3mol的NO 和Cl2以不同的氮氯比(![]() )进行反应2NO(g)+Cl2(g)
)进行反应2NO(g)+Cl2(g) ![]() 2NOCl(g) △H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:
2NOCl(g) △H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:

(4)图中T1、T2的关系为: T1____T2(填“>”、“<”或“=”)
(5)图中纵坐标为物质(填化学式)_________的转化率,理由为______________。
(6)图中A、B、C 三点中平衡时NOCl体积分数最大的是__________(填“A”、“ B” 或“C”)
(7)若容器容积为1L,则B点平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸氨溴索(H)对于治疗老年重症肺炎有良好的疗效,其合成路线如下(部分反应条件及产物已略):
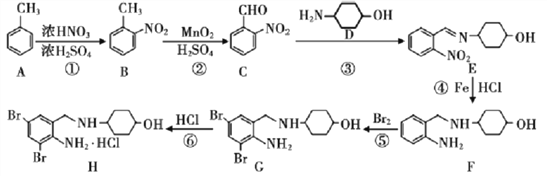
(1)B的名称为_________;反应①-⑥中为取代反应的是___________(填序号)。
(2)B的芳香族同分异构体J满足下列条件:
①可水解 ②可发生银镜反应 ③1mol J最多消耗2mol NaOH
J有________种;B的另一种芳香族同分异构体可与NaHCO3溶液反应,并有气体生成,其核磁共振氢谱有4组吸收峰,则它的结构简式为____________。
(3)可用碱性新制氢氧化铜悬浊液检验C中的特征官能团,写出该检验的离子反应方程式:____________________________。
(4)关于E的说法正确的是_________。
A.E难溶于水 B.E可使酸性KMnO4溶液褪色
C.1molE最多与1molH2加成 D.E不能与金属钠反应
(5)邻氨基苯甲酸甲酯(L)具有塔花的甜香味,也是合成糖精的中间体,以甲苯和甲醇为原料,无机试剂自选,参照H的合成路线图,设计L的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是![]() ,还含有少量
,还含有少量![]() 、
、![]() 等杂质,实验室以孔雀石为原料制备硫酸铜晶体流程如下:
等杂质,实验室以孔雀石为原料制备硫酸铜晶体流程如下:

已知相关氢氧化物沉淀的pH范围如下:
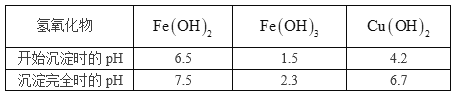
完成下列填空:
(1)滤液1中含有的金属阳离子有_______________。
(2)步骤②中所用的试剂X是________(选填编号)。
a. Fe粉 b. ![]() c. 氨水 d. KSCN
c. 氨水 d. KSCN
(3)步骤③中加入CuO的目的是________________________________________。
(4)由滤液3得到硫酸铜晶体,需要经过的步骤依次有:_________、________、过滤等。
(5)为测定所得晶体中结晶水的![]() 值,可采用加热法。取
值,可采用加热法。取![]() g晶体灼烧至结晶水全部失去,称得无水硫酸铜的质量bg。
g晶体灼烧至结晶水全部失去,称得无水硫酸铜的质量bg。
①晶体应盛装在________(填仪器名称)中进行灼烧。
②确认结晶水已全部失去的方法是___________________________。
③![]() 值的表达式为______________(用
值的表达式为______________(用![]() 、
、![]() 表示)。
表示)。
④实验结果发现测得结晶水数量![]() 偏高,可能的原因有___________(任写一种)。
偏高,可能的原因有___________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、R是元素周期表中前四周期的常见元素,相关信息如表所述:
元素 | 相关信息 |
X | 地壳中含量最多的元素 |
Y | 元素的气态氢化物极易溶于水,水溶液遇酚酞变红 |
Z | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物是自来水生产过程中常用的消毒剂 |
W | 与Z同周期,第一电离能至第四电离能分别是:I1=578kJmol﹣1 , I2=1817kJmol﹣1 , I3=2745kJmol﹣1 , I4=11575kJmol﹣1 |
R | 有多种化合价,水溶液中其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)R在元素周期表中的位置为 , X的基态原子的价电子排布图为 , Z的基态原子的电子排布式为 .
(2)用“>”、“<”或“=”填空:
简单离子半径 | 第一电离能 | 电负性 | 气态氢化物稳定性 |
XY | XY | XZ | H2XYH3 |
(3)用方程式表示下列过程: ①Y的气态氢化物的水溶液遇酚酞变红的原因 ,
②W的最高价氧化物的水化物在水中发生电离 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水中的电离方程式错误的是
A.MgSO4===Mg2++SO42-B.Ba(OH)2===Ba2++OH2-
C.NaHCO3===Na++HCO3-D.H2SO4===2H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,0.1 mol/L某酸HA溶液的pH=3。关于该溶液叙述正确的是
A. 溶质的电离方程式为HA→H+ + A- B. 升高温度,溶液的pH增大
C. 若加入少量NaA固体,则c(A-)降低 D. 该溶液稀释10倍后,pH < 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业为人类解决粮食问题做出了巨大贡献.一定条件下,在密闭容器中进行合成氨反应:N2(g)+3H2(g)2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是( )
A. N2、H2完全转化为NH3 B. N2、H2、NH3在容器中共存
C. 反应已达到化学平衡状态 D. N2、H2、NH3的浓度不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com