
| 化肥名称 | 尿素 | 碳酸氢铵 | 硫酸铵 | 氨水 |
| 溶液的pH | 7 | 8 | 5 | 11 |
| A. | 碳酸氢铵 | B. | 尿素 | C. | 氨水 | D. | 硫酸铵 |
科目:高中化学 来源: 题型:选择题
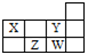
| A. | 1个37W原子中,质子数比中子数多3个 | |
| B. | Y和W处于同一主族,具有相同的最高价态 | |
| C. | Z形成简单阴离子半径小于W形成简单阴离子半径 | |
| D. | X与Y、Z与W每组两种元素间均可形成电子数相等的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
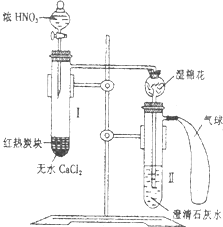 某校为了改进碳与HN03反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HN03,反应即可连续进行.
某校为了改进碳与HN03反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HN03,反应即可连续进行.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:r(Z)>r(M)>r(N)>r(Y)>r(X) | B. | 元素的负电性:Y>N>X>Z | ||
| C. | 元素的第一电离能:I1(M)>I1(Z)>I1(X) | D. | 原子中的为成对电子数:N>Y>Z>M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②③④⑤ | B. | ①③②⑤④ | C. | ①⑤③②④ | D. | ①③⑤④② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com