
2Na[Al(OH)4]+CO2══Na2CO3+2Al(OH)3↓+H2O
Na[Al(OH)4]+CO2══NaHCO3+Al(OH)3↓
又知,在一定条件下可实现下图所示物质之间的变化: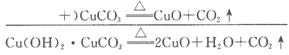
请填写以下空白:
(1)孔雀石的主要成分是Cu2 (OH)2CO3 (碱式碳酸铜),受热易分解,上图中的F是_________________________。
(2)明矾溶液与过量NaOH溶液反应的离子方程式是_________________________。
(3)图中所得G和D都为固体,混合后在高温下发生反应,化学方程式为__________________________________________________。
(4)分别写出B与HCl(aq)和NaOH(aq)反应的离子方程式:_________________。
解析:(1)Cu(OH)2受热易分解,CuCO3受热也易反应,于是Cu(OH)2·CuCO3的受热分解反应可由Cu(OH)2和CuCO3的受热分解反应而叠加:Cu(OH)2![]() CuO+H2O
CuO+H2O
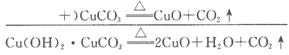
由题意,A为Na[Al(OH)4](aq),F为CuO、CO2之一,能与A发生反应,则F为CO2,那么G为CuO。
(2)明矾溶液中的Al3+与过量的OH-反应,生成[Al(OH)4]-
Al3++4OH-══[Al(OH)4]-
(3)根据题给反应,可知A与F,即Na[Al(OH)4](aq)与CO2反应生成H[Al(OH)3]沉淀,此沉淀分解产物B为Al2O3,Al2O3电解得到D为Al,D(Al)与G(CuO)可发生铝热反应:
2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
2Al2O3(熔) ![]() 4Al+3O2↑
4Al+3O2↑
2Al+3CuO![]() Al2O3+3Cu
Al2O3+3Cu
(4)B为Al2O3,既能与HCl(aq),又能与NaOH(aq)发生反应,离子方程式分别为
Al2O3+6H+══3H2O+2Al3+
Al2O3+2OH-+3H2O══2[Al(OH)4]-
答案:(1)CO2
(2)Al3++4OH-══[Al(OH)4]-
(3)2Al+3CuO![]() Al2O3+3Cu
Al2O3+3Cu
(4)Al2O3+6H+══3H2O+2Al3+
Al2O3+2OH-+3H2O══2[Al(OH)4]-


科目:高中化学 来源: 题型:阅读理解
 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
查看答案和解析>>
科目:高中化学 来源: 题型:
2Na[Al(OH)4]+CO2══Na2CO3+2Al(OH)3↓+H2O
Na[Al(OH)4]+CO2══NaHCO3+Al(OH)3↓
又知,在一定条件下可实现下图所示物质之间的变化:
请填写以下空白:
(1)孔雀石的主要成分是Cu2 (OH)2CO3 (碱式碳酸铜),受热易分解,上图中的F是_________________________。
(2)明矾溶液与过量NaOH溶液反应的离子方程式是_________________________。
(3)图中所得G和D都为固体,混合后在高温下发生反应,化学方程式为__________________________________________________。
(4)分别写出B与HCl(aq)和NaOH(aq)反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省长沙市高三第四次月考化学试卷(解析版) 题型:填空题
25℃时,电离平衡常数:
|
化学式 |
CH3COOH |
H2CO3 |
HClO |
H2C4H4O 6(酒石酸) |
H2SO3 |
|
电离平衡常数 |
2.0×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |
K1=9.1×10-4 K2=4.3×10-5 |
K1=1.3×10-2 K2=6.3×10-8 |
回答下列问题:
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3 e.Na2C4H4O6;物质的量浓度由大到小的顺序是 (填字母)。
(2)常温下,0.1mol/L的CH3COOH溶液的pH= (已知lg2=0.3)。
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-) >c(ClO-) > c(H+)
C.c(Na+) = c(HClO) +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)= c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)= c(OH-) + c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式 。
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)= 。(用准确的数值表示)
查看答案和解析>>
科目:高中化学 来源:2014届江苏省高二5月学分认定模块检测化学试卷(解析版) 题型:填空题
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
|
化学式 |
CH3COOH |
H2CO3 |
HClO |
|
|
电离平衡常数 |
Ka=1.8×10-5 |
Kal=4.3×10-7 |
Ka2=5.6×10-11 |
Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液;
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)= mol·L-1(填精确值)。
(5)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c (OH-)=2c(H2CO3)+ ;
②c(H+)+c(Na+)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com