
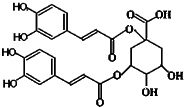
 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )| A、分子中含有6个手性碳原子 |
| B、一定条件下能发生酯化反应和消去反应 |
| C、不能与氯化铁溶液发生显色反应 |
| D、1 mol洋蓟素最多可与11 mol NaOH反应 |
 ,故A错误;
,故A错误;

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
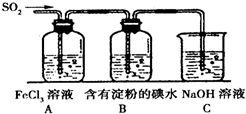 为探究SO2气体的还原性某兴趣小组设计了如装置图:
为探究SO2气体的还原性某兴趣小组设计了如装置图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
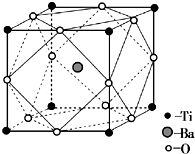 钛被誉为“未来世纪的金属”.试回答下列问题:
钛被誉为“未来世纪的金属”.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成的氢气中只含有H2 |
| B、生成的氢气中只含有D2 |
| C、生成的氢气中含有H2、HD、D2 |
| D、以上判断都不正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com