
 、
、 .
. .
. 、
、 .
. 、
、
 +
+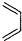 $\stackrel{△}{→}$
$\stackrel{△}{→}$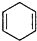 ,如果要合成
,如果要合成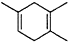 所用的原始原料可以是AC
所用的原始原料可以是AC分析 (1)某烃与H2按物质的量之比1:2加成,则该烃中含有碳碳三键或两个碳碳双键,据此写出该烃可能的结构简式;
(2)根据氧元素含量确定该有机物相对分子量,再根据该有机物的化学性质判断判断其分子式,再根据“1mol X与浓溴水反应时消耗了3molBr2”判断取代基位置,然后写出可能结构简式;
(3)根据“核磁共振氢谱图中有两个吸收峰,峰面积比为3:1”判断含有等效氢原子种类及数目,再结合分子式C4H8写出满足体积的结构简式;
(4)根据被提纯物质与杂志的性质选用合适试剂及操作方法,根据②中除杂试剂写出反应的化学方程式;
(5)根据题中反应原理及反应产物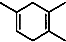 先判断炔烃结构,然后判断二烯烃的名称,从而得出正确结论.
先判断炔烃结构,然后判断二烯烃的名称,从而得出正确结论.
解答 解:(1)一定条件下某烃与H2按物质的量之比1:2加成生成CH3CH2CH(CH3)2,则该烃含2个双键或1个三键,则可能的结构简式为: 或
或 ,
,
故答案为: ;
; ;
;
(2)可与FeCl3溶液发生显色反应,则说明含有酚羟基,又X相对分子质量小于110,氧元素的质量分数为14.8%,当含有1个O原子时,其相对分子量为$\frac{16}{14.8%}$≈108,含有2个O原子时,少量为216>110,则该有机物分子中只有1个羟基,苯酚的式量为94,该有机物式量为108,108-94=12,与苯酚相差14,即相差一个CH2,则该有机物的分子式为C7H8O;
若1 mol X与浓溴水反应时消耗了3 mol Br2,说明酚羟基的邻位没有取代基,则甲基在羟基的间位,该有机物的结构简式为 ,
,
故答案为:C7H8O; ;
;
(3)分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,说明分子中存在两种H原子,且个数比为3:1,则可能的结构简式为: ;
; ,
,
故答案为: 或
或 ;
;
(4)①溴乙烷(乙醇):溴乙烷不溶于水,而乙醇易溶于水,故可用水用分液的方法分离二者,
故答案为:水、分液;
②苯酚(苯):苯酚中的苯可以先加足量NaOH溶液,苯酚变为苯酚钠,分液,然后向下层液体中通入CO2,使苯酚钠重新生成苯酚,静置后再分液,取下层液体,反应的方程式为: 、
、 ,
,
故答案为:足量NaOH溶液、CO2;分液; ;
; ;
;
(5)根据所给信息“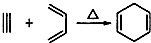 ”可知,合成
”可知,合成 的炔烃可以是:2-丁炔或丙炔,若为2-丁炔,则二烯烃为2-甲基-l,3-丁二烯,若为丙炔,则二烯烃为2,3-二甲基-l,3-丁二烯,所以A、C正确,
的炔烃可以是:2-丁炔或丙炔,若为2-丁炔,则二烯烃为2-甲基-l,3-丁二烯,若为丙炔,则二烯烃为2,3-二甲基-l,3-丁二烯,所以A、C正确,
故答案为:AC.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,试题题量较大,涉及的知识点较多,注意掌握有机物分子式、结构简式的方法,充分考查了学生对所学知识的掌握情况,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 | |
| B. | 若在恒容容器中发生反应:N2+3H2?2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 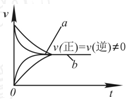 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率-时间图象可用图表示 | |
| D. | 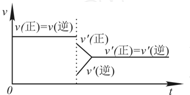 若在恒压容器中发生反应:2SO3?2SO2+O2,达到平衡后再充入适量He,其速率-时间图象可用图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
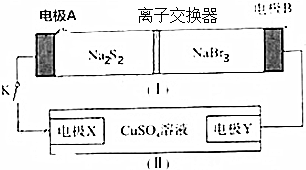
| A. | 装置①中钠离子从右到左通过离子交换膜 | |
| B. | B极的电极反应式为NaBr3+2e-+2Na═3NaBr | |
| C. | X电极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 每有0.1mol Na+通过离子交换膜,X电极上析出固体物质0.64g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 结构 | 某些性质 |
| 草酸 | 分子式:H2C2O4•2H2O | 无色,易溶于水;其钠盐和钾盐易溶于水,钙盐难溶于水 |
| 结构简式:HOOC-COOH | 熔点:101℃;升华温度:125℃;170℃以上分解 |
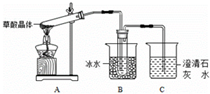
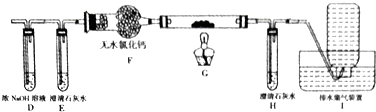
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
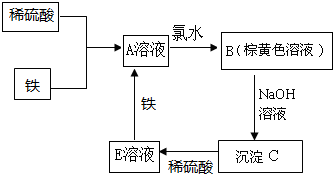 下列物质转化关系如图所示,反应过程中部分产物可能已略去请回答以下问题:
下列物质转化关系如图所示,反应过程中部分产物可能已略去请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com