
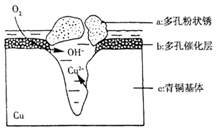
 如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图.
如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图.分析 ①Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀;
②n[Cu2(OH)3Cl]=]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子计算氧气物质的量,再根据V=nVm计算体积.
解答 解:①Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,
故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
②n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子得n(O2)=$\frac{0.02mol×2×2}{4}$=0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,
故答案为:0.448.
点评 本题考查离子方程式及原电池原理等知识点,利用原电池原理、物质性质进行解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 压强能够增大反应速率 | |
| B. | 升高温度不能影响反应速率 | |
| C. | 物质A的浓度增大,会减慢反应速率 | |
| D. | 在高温,高压和有催化剂的条件下,A与B能100%转化为C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 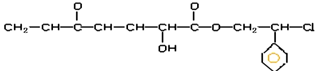 所具有的官能团种类有6种 所具有的官能团种类有6种 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 乙烯和甲烷可用酸性高锰酸钾溶液鉴别 | |
| D. | 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
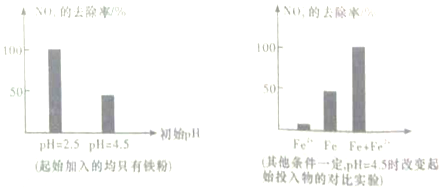
| A. | pH=4.5时,NO3-的去除率低,其原因可能是FeO(OH) 不导电,阻碍电子转移 | |
| B. | 通过对比试验发现,在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率,可能原因是Fe2+将NO3-直接还原了 | |
| C. | 加入Fe2+可能发生的反应是Fe2++2FeO(OH)═Fe3O4+2H+ | |
| D. | 由图猜测,溶液中H+浓度越大,对NO3-的去除率越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
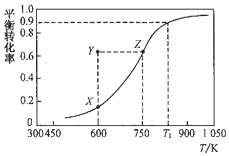 甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在IL 的密闭容器中进行).下列有关说法正确的是( )
甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在IL 的密闭容器中进行).下列有关说法正确的是( )| A. | 平衡常数:K600K>K750K | |
| B. | 从Y到Z点可通过增大压强实现 | |
| C. | 在Tl点K时,该反应的平衡常数为8.1 | |
| D. | 若工业上利用此反应进行生产,为了提高经济效益将反应温度升高至1050K以上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com