
| A. | Z的熔点较高 | B. | Z可以表示为M2Y | ||
| C. | Z可能易溶于水 | D. | M形成+2价的阳离子 |
分析 元素M的两个原子失去2个电子并转移到元素Y的两个原子上,形成化合物Z,Z为离子化合物,根据原子守恒确定Z的化学式为MY2,结合离子化合物的性质解答该题.
解答 解:A.Z为离子化合物,熔点较高,故A正确;
B.M元素的一个原子失去两个电子并转移到Y元素的两个原子中,M形成阳离子,Y形成阴离子,Z的化学式为MY2,故B错误;
C.Z为离子化合物,不一定溶于水,如CaF2,如为氯化镁,则易溶于水,故C正确;
D.M元素的一个原子失去两个电子并转移到Y元素的两个原子中,形成+2价的阳离子,故D正确.
故选B.
点评 本题考查了原子结构和元素的性质,为高频考点,侧重于学生的分析能力的考查,根据得失电子确定化学键类型,再结合原子结构、物质构成分析解答,题目难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子半径:S2->Cl->Ca2+ | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
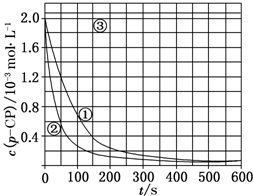 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | |||
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;B与溴水反应生成的物质名称为1,2-二溴乙烷;
;B与溴水反应生成的物质名称为1,2-二溴乙烷;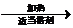
 .
.| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ OH- SO42- HCO3- | B. | OH- NH4+ SO42- Ba2+ | ||
| C. | Fe2+ H+ SO42- NO3- | D. | H+ K+ Cl- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
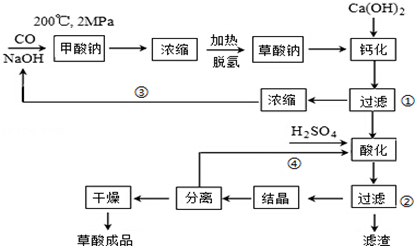
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
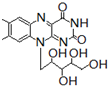
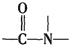 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$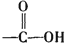 +
+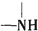 ,有关核黄素的下列说法中,正确的是( )
,有关核黄素的下列说法中,正确的是( )| A. | 该物质属于有机高分子 | B. | 不能发生酯化反应 | ||
| C. | 不能与氢气发生加成反应 | D. | 酸性条件下加热水解,有CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
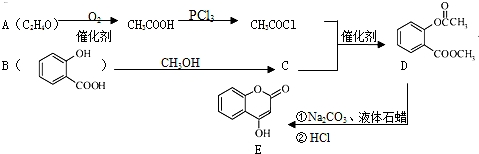
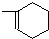
 .
. .
.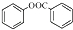 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com