
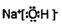 ��
������ ��֪X��Y��Z��W�ֱ���Ԫ�����ڱ��еĶ�����Ԫ�أ���ԭ��������������X��WΪͬ����Ԫ�أ�Y��ZΪͬ���ڵ�����Ԫ�أ�X��Y��Z�γɵij�����������������ȫ�����е�һ�������������ΪNH4NO3��Y��X�γɵķ�������3�����ۼ����û�����ΪNH3����XΪHԪ�ء�YΪNԪ�ء�ZΪOԪ�أ�Wԭ�ӵ�����������Y��Zԭ�ӵ�����������֮�ͣ�W��������=5+6=11��ΪNaԪ�أ��ݴ˽��н��
��� �⣺��֪X��Y��Z��W�ֱ���Ԫ�����ڱ��еĶ�����Ԫ�أ���ԭ��������������X��WΪͬ����Ԫ�أ�Y��ZΪͬ���ڵ�����Ԫ�أ�X��Y��Z�γɵij�����������������ȫ�����е�һ�������������ΪNH4NO3��Y��X�γɵķ�������3�����ۼ����û�����ΪNH3����XΪHԪ�ء�YΪNԪ�ء�ZΪOԪ�أ�Wԭ�ӵ�����������Y��Zԭ�ӵ�����������֮�ͣ�W��������=5+6=11��ΪNaԪ�أ�
��X��Y��W�ֱ�ΪH��O��NaԪ�أ��γɵĻ�����ΪNaOH����������Ϊ���ӻ���������ʽΪ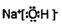 ��
��
�ʴ�Ϊ��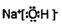 ��
��
��һ���¶��£�H2��N2���ݻ�Ϊ5L���ܱ������з������淴Ӧ�������H2��N2�����ʵ����ֱ���6mol��3mol���ﵽ��ѧƽ��״̬ʱ������NH3�����ʵ���Ϊ2.4mol��
��ʼʱ�����N2�� H2 �����ʵ����ֱ���3.0mol��6.0mol��ƽ��ʱ����NH3�����ʵ�����2.4mol��
��ƽ��ʱ���ĵ��������ʵ���Ϊx����Ӧ��������ٵ����ʵ���Ϊy��
N2+3H2?2NH3 ��n
1 3 2 2
x 2.4mol y
��x=$\frac{1��2.4mol}{2}$=1.2mol��y=$\frac{2.4mol��2}{2}$=2.4mol��
ƽ��ʱ���������ʵ���Ϊ��6mol+3mol-2.4mol=6.6mol�����������ʵ���Ϊ��3mol-1.2mol=1.8mol��
��ͬ���������������������������ʵ�������������ƽ��ʱ�������������=$\frac{1.8mol}{6.6mol}$��100%=27.3%��
�ʴ�Ϊ��27.3%��
���� ���⿼��λ�ýṹ�����ʹ�ϵ��Ӧ�á���ѧƽ��ļ��㣬��Ŀ�Ѷ��еȣ��ƶ�Ԫ��Ϊ���ؼ���ע�����ղ������ڻ�ѧ�����е�Ӧ�ã�����������ѧ���ķ�����������ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����̶�����H+Ũ������ | B�� | ����̶ȼ�С��H+Ũ�ȼ�С | ||
| C�� | ����̶�����H+Ũ�ȼ�С | D�� | ����̶ȼ�С��H+Ũ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ٺ͢� | B�� | �ٺ͢� | C�� | �ں͢� | D�� | �ں͢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
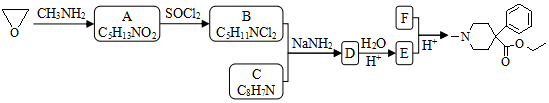
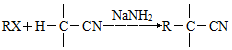
 ��
��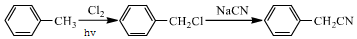 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CaCl2 | B�� | NH3 | C�� | H2O | D�� | KOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ԭ�ӵ�ԭ�ӽṹʾ��ͼ�� | |
| B�� | �Ȼ�淋ĵ���ʽ��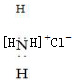 [H [H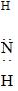 H]+Cl- H]+Cl- | |
| C�� | ԭ�Ӻ�����10�����ӵ���ԭ�ӣ�188O | |
| D�� | �õ���ʽ��ʾˮ���γɹ��̣�H��+ +��H�� +��H��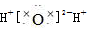 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
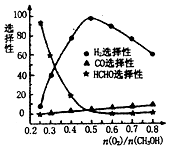 ̼Ԫ�ؼ��仯������������������ϢϢ��أ���ش��������⣺
̼Ԫ�ؼ��仯������������������ϢϢ��أ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʢ��SO2���ܱ������к���NA����ԭ�ӣ���SO2�����ʵ���Ϊ0.5 mol | |
| B�� | 28g��ϩ�ͻ����飨C3H6����ɵĻ�����壬��ȫȼ��ʱ��ת�Ƶĵ�����Ϊ12NA | |
| C�� | 0.1 mol•L-1�ģ�NH4��2SO4��Һ�У�����NH4+��С��0.2NA | |
| D�� | ��״���£�2.24 L18O2�к���2NA������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
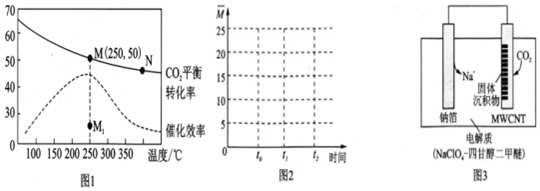
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com