
【题目】两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L。下列各组混合烃中不符合此条件的是( )
A.CH4 C2H4B.CH4 C3H6
C.C2H4 C3H4D.C2H4 CH4
科目:高中化学 来源: 题型:
【题目】已知热化学方程式SO2(g)+1/2O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量
A. 等于196.64kJ B. 等于196.64kJ·mol-1
C. 小于196.64kJ D. 大于196.64kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:

(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。

① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物M和N的说法正确的是
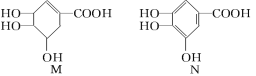
A.等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等
B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等
C.一定条件下,两种物质都能发生酯化反应和氧化反应
D.N分子中,可能在同一平面上的原子最多有14个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g)
2HI(g)
(1)保持容器容积不变,向其中充入1 mol H2,反应速率_____(填“增大”、“减小”或“不变”,下同)。
(2)升高温度,反应速率_____。
(3)扩大容器体积,反应速率_____。
(4)保持容器内气体压强不变,向其中充入1 mol H2(g)和1 mol I2(g),反应速率_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。

已知:①Fe3+ Cu2+ 开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为①
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4.6 g金属钠投入到足量水中,得ag溶液;将4.8 g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为 ( )
A.a=bB.a>b
C.a<bD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向一容积为2L的恒容密闭容器中充入2molA与3molB,在一定条件下反应:A(g)+B(g)C(g),△H >0,达到平衡后容器内压强是开始时的84%。若加入某种催化剂后反应的能量变化如图所示。下列说法正确的是( )

A.由图可知,加入催化剂之后,原反应分成了两步,第一步反应较慢
B.若40s后达到平衡,则用A表示该反应的速率为0.01molL-1min-1
C.当容器c(B)/c(A)不再改变时,不能说明该反应达到了平衡状态
D.达到平衡时,C的体积分数约为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料。具有较强的还原性,可用于棉织物漂白后的脱氯剂,定量分析中的还原剂。易溶于水,不溶于乙醇。Na2S2O35H2O于40~45℃熔化,48℃分解。实验室中常用亚硫酸钠和硫磺制备Na2S2O35H2O。制备原理为:Na2SO3+S+5H2O═Na2S2O35H2O。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。
Ⅰ.实验室制取Na2S2O35H2O晶体的步骤如下:
①称取12.6 g Na2SO3于烧杯中,溶于80.0 mL水。
②另取4.0 g硫粉,用少许乙醇润湿后,加到上述溶液中。
③水浴加热(如图1所示,部分装置略去),微沸,反应约1小时后过滤。
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O35H2O晶体。
⑤进行减压过滤(如图2所示)、乙醇洗涤并干燥。请回答:
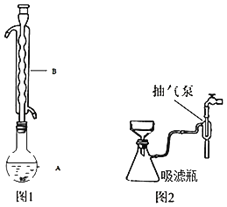
(1)仪器B的名称是_____。
(2)步骤④在浓缩过程中不能蒸发过度,其原因是_____。步骤⑤如欲停止抽滤,应先将吸滤瓶支管上的橡皮管拔下,再关抽气泵,其原因是_____。
(3)洗涤时为尽可能避免产品损失应选用的试剂是_____。
A.水 B.乙醇 C.氢氧化钠溶液 D.稀盐酸
Ⅱ.设计以下实验流程探究Na2S2O3的某些化学性质
![]()
(4)实验①Na2S2O3溶液pH=8的原因是_____(用离子方程式表示)。
(5)写出实验②中发生的离子反应方程式_____。
Ⅲ.用Na2S2O3的溶液测定溶液中ClO2的物质的量浓度,可进行以下实验。
步骤1:准确量取ClO2溶液10.00mL,稀释成100mL试样。
步骤2:量取V1 ML试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟(已知:ClO2+I﹣+H+—I2+Cl﹣+H2O 未配平)。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。
(6)滴定终点现象是_____。根据上述步骤计算出原ClO2溶液的物质的量浓度为_____ mol/L(用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com