
| A. | C3H8 | B. | C3H4 | C. | C2H2 | D. | C3H6 |
分析 设该烃的化学式为CxHy,反应前后的压强不变,则气体的物质的量不变,结合反应的化学方程式CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O可知:1+x+=x+$\frac{y}{4}$,据此进行计算和判断.
解答 解:设该烃的化学式为CxHy,所以
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O
燃烧前后容器内(均在120℃)压强保持不变,则气体的物质的量不变,
则:1+x+=x+$\frac{y}{4}$,
解得:y=4,
即烃中含有的H原子数为4,
故选B.
点评 本题考查有机物分子式的确定,题目难度中等,注意从有机物燃烧的方程式结合体积的变化进行解答,试题培养了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<HNO3 | D. | 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯乙烯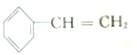 | B. | 苯甲酸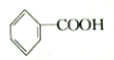 | C. | 苯甲醛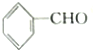 | D. | 苯乙酮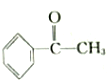 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
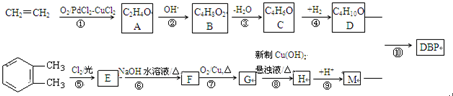
 .
. .
.

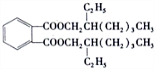 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 装修常用的人造板材容易引起居室甲醛污染 | |
| B. | 用于制作集成电路板的酚醛树脂是天然高分子化合物 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 为提高农作物的产量和质量,应大量使用化肥和农药 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
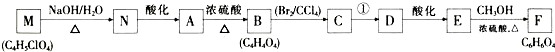
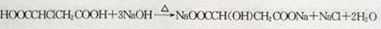 ;
;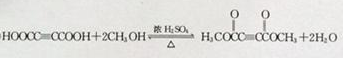 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com