
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
| 1 | 3.0 | V | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
分析 (1)从表中数据可知改变的条件是H2C2O4浓度,根据H2C2O4溶液浓度不同,浓度越大,反应速率越快,浓度越小,反应速率就越慢进行解答;
(2)利用实验2、3中的数据,可知溶液的总体积为10.0mL,所以实验1中V=2.00mL;溶液褪至无色即KMnO4反应完所需时间为1.5min,计算出用KMnO4表示的化学反应速率.
解答 解:(1)在表中,其它条件相同,而H2C2O4溶液浓度不同,浓度越大,反应速率越快,浓度越小,反应速率就越慢.因此根据表格的实验数据,可以得到的结论是其他条件不变时,增大反应物浓度,加快化学反应速率,
故答案为:其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大;
(2)利用实验2、3中的数据,可知溶液的总体积为10.0mL,所以实验1中V=2.00mL;计算用KMnO4表示的化学反应速率为v(KMnO4)=$\frac{△c}{△t}$=$\frac{0.05mol•{L}^{-1}×3.0×1{0}^{-3}L}{10×1{0}^{-3}L×1.5min}$=1.0×10-2mol/(L•min),
故答案为:2.0;1.0×10-2mol/(L•min).
点评 本题主要结合实验考查了影响化学反应速率的因素,题目难度中等,注意掌握浓度对化学反应速率的影响,解题关键是对比分析图表中的数据找出相同点和不同点,然后得出合理结论,试题培养了学生的分析能力及化学实验能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 丙烯 | B. | 对二甲苯 | C. | 1-甲基-4-乙基苯 | D. | 1-甲基-2-乙基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:| 编号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解 的时间/s |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 细小颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
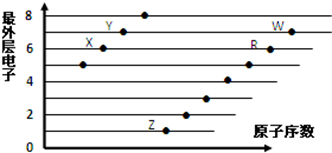
| A. | X和R在同一周期 | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的酸性:X>Y | |
| D. | X、Z形成的化合物中阴阳离子个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是吸热反应都需要加热 | |
| B. | 物质的化学变化都伴随着能量变化 | |
| C. | 表示中和热的热化学方程式:NaOH+HCl═NaCl+H2O△H=-57.3 kJ•mol-1 | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,前者的反应热比后者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
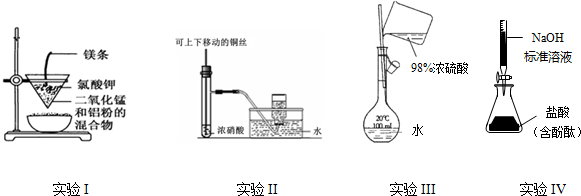
| A. | 实验I:制备金属锰 | |
| B. | 实验II:制备并收集NO2 | |
| C. | 实验III:配置一定的物质的量浓度的稀硫酸溶液 | |
| D. | 实验IV:测定未知盐酸的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com