
| A. | 2014年11月10日APCE国宴采用的帝王彩瓷餐具和常见的水晶饰品都属于硅酸盐制品 | |
| B. | 20mL0.1mol•L-1NaOH分别与10mL 0.2mol•L-1 CH3COOH、20mL0.1mol•L-1 CH3COOH反应,前者放出的热量比后者少 | |
| C. | Na2SO4•10H2O$?_{冷却}^{受热}$Na2SO4+10H2O利用该反应可以实现太阳能和化学能的相互转换 | |
| D. | 浓硫酸具有不同于稀硫酸的强氧化性、吸水性和脱水性等,主要是由于稀硫酸和浓硫酸中存在的主要微粒不同引起的 |
分析 A.水晶的主要成分为二氧化硅;
B.醋酸为弱电解质,电离需要吸收热量;
C.芒硝就是十水硫酸钠.温度较高时,脱去结晶水,是吸热过程,低温下,结合结晶水,是放热过程;
D.硫酸在水溶液中解离,须有水分子参与,形成的实质上并非氢离子和硫酸根,而是这两种离子的水合态,而浓硫酸中含有极少的水,不足以大量形成水和离子,故以硫酸分子形式存在.
解答 解:A.水晶的主要成分为二氧化硅,不属于硅酸盐材料,故A错误;
B.10mL 0.2mol•L-1 CH3COOH、20mL0.1mol•L-1 CH3COOH反应,前者浓度较大,电离吸收热量多,与20mL0.1mol•L-1NaOH都能反应,放出的中和热相同,但是前者吸收热量多,所以最终放出热量少,故B正确;
C.芒硝就是十水硫酸钠.温度较高时,脱去结晶水,是吸热过程,低温下,结合结晶水,是放热过程.因此可以利用这个原理储备和放出热量,实现太阳能和化学能的相互转换,故C正确;
D.浓硫酸具有不同于稀硫酸的强氧化性、吸水性和脱水性等,主要是由于稀硫酸和浓硫酸中存在的主要微粒不同引起的,故D正确;
故选:A.
点评 本题为综合题,考查了硅酸盐材料的成分,反应的热效应、浓硫酸的性质,题目难度中等,熟悉相关知识是解题关键.


科目:高中化学 来源: 题型:解答题
 化合物Na2O的晶胞如图.
化合物Na2O的晶胞如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
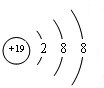
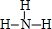 ; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
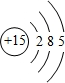 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
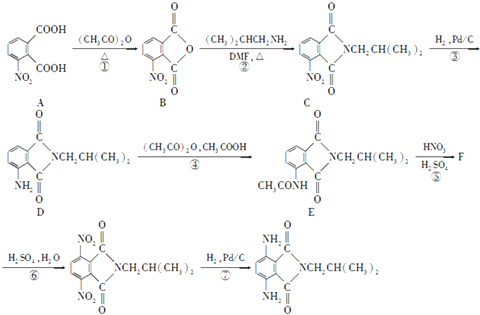
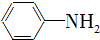 )有还原性,易被氧化;
)有还原性,易被氧化;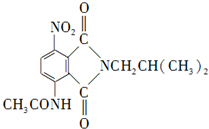 .
.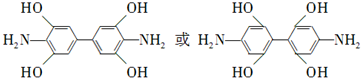 .
.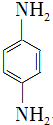 )是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
)是一种重要的染料中间体.根据已有知识并结合相关信息,写出以苯、(CH3CO)2O及CH3COOH为主要有机原料制备对苯二胺的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
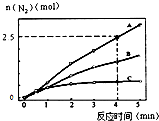
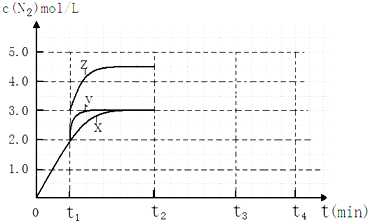
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的主族序数与周期数的差为4,且不与A元素在同一周期 |
| E是第四周期中含未成对电子数最多的元素 |
| F基态原子外围电子排布式为(n+1)d3n(n+2)Sn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
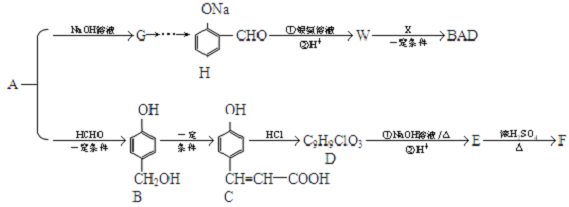
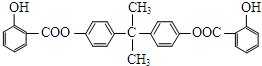
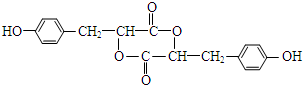
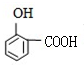 .
.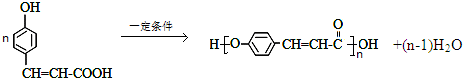 .
.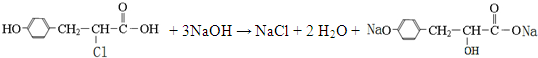 .
.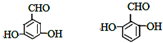 (其中一种).
(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
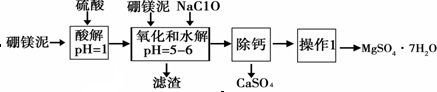
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com