
| A. | NaOH | B. | Na2CO3 | C. | Na2CO3、NaHCO3 | D. | NaOH、Na2CO3 |
分析 酚酞作指示剂时终点呈碱性,存在NaHCO3;甲基橙滴定终点呈酸性,全部生成NaCl,
V1和V2关系如下:
NaOH时V1=V2;
Na2CO3时2V1=V2;
NaHCO3时V1=0,V2>0,以此解答该题.
解答 解:酚酞的变色范围为8~10,作指示剂时终点呈碱性,存在NaHCO3;
而甲基橙的变色范围为3.1~4.4,滴定终点呈酸性,全部生成NaCl,
V1和V2关系如下:
NaOH时V1=V2;
Na2CO3时2V1=V2;
NaHCO3时V1=0,V2>0,
已知V2>V1,
则NaCl含有Na2CO3、NaOH,或Na2CO3、NaHCO3,或只有Na2CO3,不可能只有NaOH,
故选A.
点评 本题考查混合物的计算和判断,侧重于学生的分析、计算能力的考查,题目涉及NaOH、NaHCO3、Na2CO3与HCl反应,要注意酚酞和甲基橙为指示剂时变色范围,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:7 | B. | 2:1 | C. | 2:7 | D. | 7:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝在空气中易被氧化,表面形成一层氧化膜 | |
| B. | 铝的性质活泼,不易冶炼;铜的性质不活跃,易于冶炼 | |
| C. | 单质铜的颜色比铝鲜艳,人们喜欢使用 | |
| D. | 氯元素进入人体度人体有害,油漆对人的智力有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
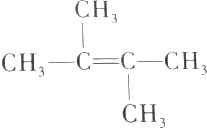 ,下列有关该烯烃分子的叙述中正确的是( )
,下列有关该烯烃分子的叙述中正确的是( )| A. | 该烯烃分子中的所有原子都在同一平面上 | |
| B. | 该烯烃分子中有4个碳原子可能在一条直线上 | |
| C. | 该烯烃分子中的6个碳原子不可能都在同一平面上 | |
| D. | 该烯烃与CH2=C(CH2CH3)2互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 33.3% | C. | 50% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度的氨水加水稀释的过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的比值增大 | |
| B. | 假设HClO的电离平衡常数为Ka,碳酸的电离常数分别记为:Ka1 和Ka2,已知:Ka1>Ka>Ka2,则发生反应:2NaClO+CO2(少量)+H2O=Na2CO3+2HClO | |
| C. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| D. | 室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com