
(1)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
。
 (2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS====Na2Sx,正极的电极反应式为 。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS====Na2Sx,正极的电极反应式为 。
M(由Na2O和Al2O3制得)的两个作用是 。
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 倍。
(3)以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式为 。理想状态下,该燃料电池消耗1 mol甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为 (燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,甲醇的燃烧热为ΔH=-726.5 kJ·mol-1)。
(1)根据电池正、负极反应的物质和电解质溶液,分析反应物和生成物,根据电子守恒进行配平。
(2)正极的电极反应式为xS+2e-====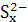 ,M的作用一是导电,二是因钠与硫易反应,故它起到隔离作用;钠高能电池中负极为钠,有23 g钠消耗释放1 mol e-,则207 g钠消耗时转移207/23 mol e-,铅蓄电池的电池反应为Pb+PbO2+2H2SO4====2PbSO4+2H2O,铅蓄电池中铅是负极,207 g铅消耗时转移2 mol e-,故钠硫电池的理论放电量是铅蓄电池的207÷23÷2=4.5倍。
,M的作用一是导电,二是因钠与硫易反应,故它起到隔离作用;钠高能电池中负极为钠,有23 g钠消耗释放1 mol e-,则207 g钠消耗时转移207/23 mol e-,铅蓄电池的电池反应为Pb+PbO2+2H2SO4====2PbSO4+2H2O,铅蓄电池中铅是负极,207 g铅消耗时转移2 mol e-,故钠硫电池的理论放电量是铅蓄电池的207÷23÷2=4.5倍。
(3)该燃料电池的理论效率=702.1 kJ÷726.5 kJ×100%≈96.6%。
答案:(1)Ag2O2+2Zn+4KOH+2H2O====2K2Zn(OH)4+2Ag
(2)xS+2e-====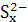 (或2Na++xS+2e-====Na2Sx)
(或2Na++xS+2e-====Na2Sx)
导电和隔离钠与硫 4.5
(3)CH3OH+H2O-6e-====CO2+6H+
3/2O2+6H++6e-====3H2O 96.6%


科目:高中化学 来源: 题型:
现有九种物质:①铝线 ②氯气 ③石墨 ④BaSO4晶体 ⑤纯硫酸 ⑥金刚石 ⑦石灰水 ⑧酒精 ⑨熔融KNO3
其中能导电的是 ,属电解质的是 ,既不是电解质也不是非电解质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应A+B=C+D 在低温下能自发进行,在高温下不能自发进行,对该反应过程△H、△S的判断正确的是( )
|
| A. | △H<0△S>0 | B. | △H>0△S>0 | C. | △H<0△S<0 | D. | △H>0△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是几种常见的化学电源示意图,有关说法不正确的是 ( )
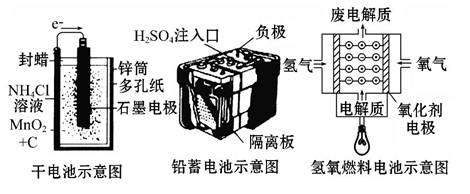
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
有如下3个实验:
| 实验1 | 将金属X与金属Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
| 实验2 | 将片状的金属X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈 |
| 实验3 | 用惰性电极电解等物质的量浓度的Y和金属Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
依据上述实验现象,下列推测中正确的是 ( )
A.金属的活动性顺序:Y>Z>X>W
B.实验1中,Y作正极
C.Z放入CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸可构成原电池,X作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍.下列说法正确的是( )
|
| A. | R的原子半径比Z的大 |
|
| B. | R的氢化物的热稳定性比W的强 |
|
| C. | X与Y形成的化合物只有一种 |
|
| D. | Y的最高价氧化物的水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题:
(1)①反应Cl2+H2O⇌H++Clˉ+HClO其化学平衡常数K的表达式为:
②在25℃下,将a mol•L﹣1的氨水与0.01mol•L﹣1的盐酸等体积混合,反应平衡时溶液中c(NH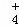 )=c(Cl﹣),试用含a的代数式表示NH3•H2O的电离常数Kb= .
)=c(Cl﹣),试用含a的代数式表示NH3•H2O的电离常数Kb= .
(2)常温下,向一定体积的0.1mol•L﹣1醋酸溶液中加水稀释后,下列说法正确的是 .
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中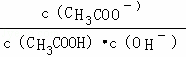 不变
不变
D.溶液中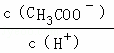 减小
减小
(3)①常温下将0.15mol•L﹣1的稀硫酸V1 mL与0.1mol•L﹣1的NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2= (溶液体积的变化忽略不计,硫酸电离方程式:H2SO4=2H++SO42﹣).
②常温下将pH=3的醋酸溶液V1 mL与pH=11的NaOH溶液V2 mL混合,则下列说法正确的是 .
A.若混合后溶液呈中性,则c(H+)+c(OH﹣)=2×10﹣7 mol•L﹣1
B.若V1=V2,混合后溶液的pH一定等于 7
C.若混合后溶液呈酸性,则V1一定大于V2
D.若混合后溶液呈碱性,则V1一定小于V2
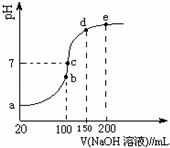
(4)NH4HSO4在分析试剂、医药、电子工业中用途广泛.现向100mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.试分析图中a~e 5个点,回答下列问题:
①水的电离程度最大的是 点;
②在c点,溶液中各离子浓度由大到小的排列顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: 时,
时, 的
的 。下列判断正确的是
。下列判断正确的是
A.  时,饱和
时,饱和 溶液与饱和
溶液与饱和 溶液相比,前者的
溶液相比,前者的 大
大
B.  时,在
时,在 的悬浊液中加入少量的
的悬浊液中加入少量的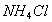 固体,
固体,  增大
增大
C.  时,
时, 固体在20mL0.01
固体在20mL0.01 氨水中的
氨水中的 比在20mL0,01
比在20mL0,01
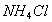 溶液中的
溶液中的 小,
小,
D.  时,在
时,在 的悬浊液中加入
的悬浊液中加入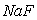 溶液后
溶液后 不可能转化为
不可能转化为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com