
| A. | 为了提取电子垃圾中有用的金属,可将其进行焚烧 | |
| B. | 模型一般可分为物体模型和思维模型 | |
| C. | 某同学研究SO2性质的程序是分类(预测SO2的化学性质)→观察(得出SO2的物理性质)→实验→比较并得出结论 | |
| D. | 科学实验能解决化学学科的所有问题 |
分析 A.焚烧会产生气体污染;
B.模型分为物体模型和思维模型;
C.对物质的性质的研究一般是由浅到深;
D.并不是化学上所有问题都可以通过实验解决.
解答 解:A.焚烧会产生有毒气体,污染大气,故A错误;
B.模型一般可分为物体模型和思维模型,故B正确;
C.对物质性质进行研究的基本程序是:观察物质的外观性质→预测物质性质→设计实验→观察实验现象→对实验现象进行分析、解释→得出结论,故C错误;
D.实验是化学科学的特征但并不是化学上所有问题都可以通过实验解决,有的需要从理论上进行分析、推理,故D错误.
故选B.
点评 本题考查了化学研究的基本方法和作用,难度不大,侧重对基础知识的巩固,注意对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量的氨水Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 铝片投入硝酸汞溶液中:Al+Hg2+═Al3++Hg | |
| D. | 金属钠投入水中:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z为0.3 mol/L | B. | Y2为0.1 mol/L | C. | X2为0.2 mol/L | D. | Z为0.35mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,
已知热化学方程式H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一组探究氯气性质的装置.
如图是一组探究氯气性质的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,浓度均为0.2mol•L-1的NaHCO3和Na2CO3溶液中,都存在电离平衡和水解平衡,分别加入NaOH固体恢复到原来的温度,c(CO32- )均增大 | |
| B. | 已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol•L-1的NaA和NaB混合溶液中,c(Na+)>c(B-)>c(A-)>c( OH-)>c(HA)>c(HB)>c(H+) | |
| C. | pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,其浓度:c(CH3COONa)>c(C6H5ONa)>c( Na2CO3)>c(NaOH) | |
| D. | 一定温度下,pH相同的溶液,由水电离产生的c(H+)相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
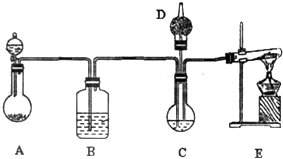 纳米碳酸钙有广泛的应用前景.用下图所示装置,在浓CaCl2溶液中通入NH3和CO2可制得纳米级碳酸钙.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
纳米碳酸钙有广泛的应用前景.用下图所示装置,在浓CaCl2溶液中通入NH3和CO2可制得纳米级碳酸钙.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com