
【题目】现有浓度均为0.1mol·L-1的下列溶液:①盐酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤硫酸氢铵 ⑥氨水,请回答下列问题:
(1)已知t ℃时,Kw=1×10-13,则t ℃(填“>” “<”或“=”)__25℃。
(2)②③④三种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)____。
(3)已知④溶液呈酸性,请用离子方程式表示___。
(4)④⑤⑥四种溶液中NH4+浓度由大到小的顺序是(填序号)____。
(5)常温下,将①和③按体积比2:1混合后,溶液的pH约为____(已知lg3=0.5)。
【答案】> ④②③ NH4++H2ONH3·H2O+H+ ⑤④⑥ 1.5
【解析】
(1)水的电离是吸热反应,升高温度促进水电离;
(2)酸碱抑制水的电离,可以水解的盐类促进水的电离,据此分析即可;
(3)盐类水解是盐呈现酸碱性的原因;
(4)化学式中铵根离子个数相等的强电解质中,醋酸根离子促进铵根离子水解,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小,据此解答即可;
(5)依据混合溶液pH计算方法计算即可。
(1)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,t℃时,Kw=1×1013>1014,所以t℃>25℃,
故答案为:>;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大,等浓度的这几种溶液中,NH4Cl促进水电离,醋酸中氢离子浓度小于0.1mol/L、NaOH中氢氧根离子浓度为0.1mol/L,所以②③④溶液中由水电离出的H+浓度由大到小的顺序是④②③,
故答案为:④②③;
(3) 氯化铵属于强酸弱碱盐,铵根离子在溶液中水解呈酸性,水解方程式为NH4++H2ONH3·H2O+H+,
答案为:NH4++H2ONH3·H2O+H+;
(4)化学式中铵根离子个数相等的强电解质中,氯离子对铵根离子水解无影响,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小,所以等浓度的这几种溶液中,铵根离子浓度大小顺序是⑤④⑥,
故答案为:⑤④⑥;
(5)在t℃时将0.1molL1的HCl溶液与0.1molL1的NaOH的溶液按体积比2:1混合(忽略混合后溶液体积的变化),则有:c(H+)=![]() =
=![]() mol/L,则pH=lg
mol/L,则pH=lg![]() =(10.5)=1.5,
=(10.5)=1.5,
故答案为:1.5。


科目:高中化学 来源: 题型:
【题目】某物质结构简式如图所示,下列说法不正确的是

A.该有机物分子中所有原子不可能都共平面
B.该有机物能发生加成反应、氧化反应、水解反应、消去反应等
C.该有机物能与FeCl3溶液发生显色反应
D.1 mol该有机物最多可与5mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,固定容积的密闭容器中反应2NO2(g)![]() O2(g)+2NO(g)ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是( )
O2(g)+2NO(g)ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是( )

A.当X表示压强时,Y表示NO2的转化率
B.当X表示温度时,Y表示O2的物质的量
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应aA+bB![]() cC中,5分钟时分别测得在不同温度下物质的含量A%和C%,绘制变化曲线如图所示,下列说法正确的是( )
cC中,5分钟时分别测得在不同温度下物质的含量A%和C%,绘制变化曲线如图所示,下列说法正确的是( )

A. 该反应在T1、T3温度时达到过化学平衡
B. 该反应在T2温度时达到过化学平衡
C. 该反应的逆反应是放热反应
D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则:2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6kJ·mol-1
B.将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1,则CH3OH(g)的燃烧热为192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1,则CH3OH(g)的燃烧热为192.9kJ·mol-1
C.已知氢在氯气中燃烧的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=-285.8kJ/mol,所以H2(g)的燃烧热是285.8kJ·mol-1,
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离方程式是H2O![]() H++ OH-。下列叙述正确的是( )
H++ OH-。下列叙述正确的是( )
A.升高温度,KW增大,pH不变
B.向水中加入少量硫酸,c(H+)增大,KW不变
C.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn和Bi形成的晶体薄膜是一种金属间化合物![]() 晶胞结构如图
晶胞结构如图![]() ,有关说法正确的( )
,有关说法正确的( )
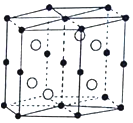
A.锰价电子排布为![]()
B.Bi是d区金属
C.该合金堆积方式是简单立方
D.该晶体的化学式为MnBi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+2B(g)![]() C(g)+D(g) △H=-QkJ·mol-1的能量变化如图所示,有关叙述正确的是( )
C(g)+D(g) △H=-QkJ·mol-1的能量变化如图所示,有关叙述正确的是( )
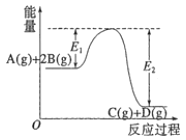
A.Q=E1-E2
B.在反应体系中加入催化剂,反应速率增大,E1减小,E2不变
C.Q>0,升高温度,正反应速率增大,逆反应速率减小
D.若减小体积,平衡会移动,当反应再次达到平衡时,A的平衡浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D. 金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12
金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com