
| A. | Al(OH)3═Al3++3OH- | B. | KHSO4═K++H++SO${\;}_{4}^{2-}$ | ||
| C. | CH3COOH?H++CH3COO- | D. | NaH2PO4?Na++H2PO${\;}_{4}^{-}$ |
分析 A.氢氧化铝为弱碱,电离方程式用可逆号;
B.硫酸氢钾为强电解质,在溶液中完全电离出钾离子、氢离子和硫酸根离子;
C.醋酸为弱酸,在溶液中部分电离出氢离子,电离方程式用可逆号;
D.NaH2PO4为强电解质,完全电离,电离方程式用等号.
解答 解:A.氢氧化铝为弱碱,电离方程式不能用等号,其正确的电离方程式为:Al(OH)3?Al3++3OH-,故A错误;
B.硫酸氢钾的电离方程式为:KHSO4═K++H++SO42-+OH-,故B正确;
C.醋酸为弱酸,其电离方程式为:CH3COOH?H++CH3COO-,故C正确;
D.NaH2PO4为强电解质,完全电离,电离方程式为NaH2PO4=Na++H2PO4-,故D错误;
故选BC.
点评 本题考查电离方程式的正误判断,为高频考点,题目难度不大,把握电解质强弱及电离程度为解答的关键,注意掌握电离方程式的书写原则.


科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH=CH3COO-+H+ | B. | NaOH=Na++OH- | ||
| C. | NH4Cl?NH4++Cl- | D. | NaHCO3=Na++H++CO32-. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石因其硬度大和熔点高,所以人们目前还不能进行人工合成 | |
| B. | 无机非金属材料、金属材料和高分子材料都是我们生活和生产中不可缺少的材料,但高分子材料的共同特点是熔点低、硬度小,因此不耐高温 | |
| C. | 钛合金是新兴的形状记忆合金,将它置于人的大脑可以增强记忆功能 | |
| D. | 金属腐蚀会带来严重的危害和损失,但也可被用来进行材料加工 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液与CuSO4溶液反应:Ba2++SO42-=BaSO4↓ | |
| B. | NaOH溶液与稀硫酸的反应:OH-+H+=H2O | |
| C. | NaHCO3溶液与盐酸的反应:HCO3-+H+=H2O+CO2↑ | |
| D. | KCl溶液与AgNO3溶液的反应:Cl-+Ag+=AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用药匙取用粉末状或颗粒状固体 | B. | 用胶头滴管滴加少量液体 | ||
| C. | 倾倒液体时试剂瓶标签面向手心 | D. | 给盛有$\frac{2}{3}$体积液体的试管加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
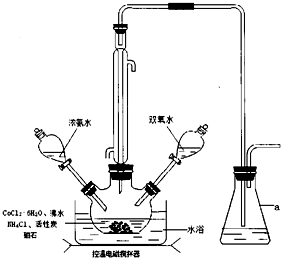
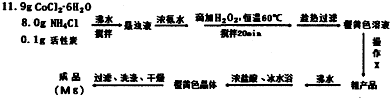
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com