
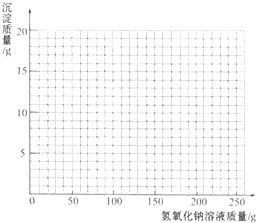
 烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
分析 (1)由表中数据可知,加热200mL与250mLNaOH溶液时,沉淀质量不再变化,故生成沉淀氢氧化铜的质量为9.8g;根据Cu元素守恒计算混合溶液中硫酸铜的质量;
(2)氢氧化钠与硫酸、硫酸铜反应生成硫酸钠,根据硫酸根守恒计算硫酸钠物质的量,再根据钠离子守恒计算氢氧化钠的质量,而计算氢氧化钠溶液质量;
(3)开始发生反应:H2SO4 +2NaOH=Na2SO4+2H2O,计算中和硫酸需要氢氧化钠的质量,结合质量分数计算需要氢氧化钠溶液的质量,而后发生反应:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,结合(2)中计算可知沉淀最大时消耗NaOH溶液质量,由(1)中分析可知沉淀最大质量.
解答 解:(1)由表中数据可知,加热200mL与250mLNaOH溶液时,沉淀质量不再变化,故生成沉淀氢氧化铜的质量为9.8g;根据Cu元素守恒,n(CuSO4)=n[Cu(OH)2]=$\frac{9.8g}{98g/mol}$=0.1mol,故m(CuSO4 )=0.1mol×160g/mol=16g,
故答案为:9.8g;16g;
(2)硫酸的物质的量为$\frac{9.8g}{98g/mol}$=0.1mol,发生反应:H2SO4 +2NaOH=Na2SO4+2H2O,CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,氢氧化钠与硫酸、硫酸铜反应生成硫酸钠,根据硫酸根守恒:n(Na2SO4)=n(H2SO4)+n(CuSO4)=0.1mol+0.1mol=0.2mol,根据钠离子守恒:n(NaOH)=2n(Na2SO4)=0.4mol,故需要氢氧化钠的质量为0.4mol×40g/mol=16g,需要10%氢氧化钠溶液质量为$\frac{16g}{10%}$=160g,
答:参加反应的NaOH溶液的总质量是160克;
(3)开始发生反应:H2SO4 +2NaOH=Na2SO4+2H2O,中和硫酸需要氢氧化钠为0.1mol×2=0.2mol,需要氢氧化钠溶液的质量为$\frac{0.2mol×40g/mol}{10%}$=80g,结合(2)中计算可知沉淀最大时消耗NaOH溶液质量为160g,由(1)中分析可知沉淀最大质量为9.8g,故混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线为: ,故答案为:
,故答案为: .
.
点评 本题考查混合物计算,关键是明确发生,注意利用守恒法解答,侧重考查学生分析计算能力,(3)中注意抓住起点、折点及曲线走势,难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
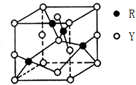 X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.
X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L Cl2完全溶于氢氧化钠溶液时,转移电子数为NA | |
| B. | 常温下,1 L pH=1的H2SO4溶液中含有的H+的数目为0.2NA | |
| C. | 标准状况下,2.24 L NH3中含有共价键的数目为0.3NA | |
| D. | 常温下,22.4 L NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
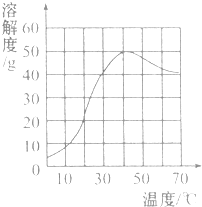
| A. | 硫酸钠的溶解度随温度升高而增大 | |
| B. | 30℃时硫酸钠饱和溶液的质量分数为40% | |
| C. | 40℃时硫酸钠的溶解度约为50g | |
| D. | 60℃时硫酸钠饱和溶液降温后一定饱和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
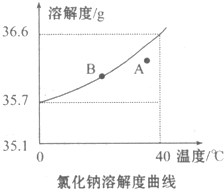 根据氯化钠的溶解度曲线,完成下列问题.
根据氯化钠的溶解度曲线,完成下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 橡胶 | B. | 纤维 | C. | 塑料 | D. | 玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 金属性:D>C | |
| D. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L NaHCO3溶液中含有0.1NA个HCO${\;}_{3}^{-}$ | |
| B. | 78gNa2O2与足量CO2反应,转移电子数为NA | |
| C. | 100℃时,1L pH=1的硫酸溶液中,含有0.05NA个SO42- | |
| D. | 常温常压下,4g CH4含NA个共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com