
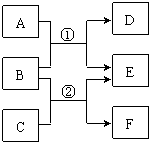
 A��F����ѧ�������ʣ�����B��D��F��Ϊ���ʣ����ǵ��ת����ϵ��ͼ��ʾ��
A��F����ѧ�������ʣ�����B��D��F��Ϊ���ʣ����ǵ��ת����ϵ��ͼ��ʾ��
| ||
| ||
| ||
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | ��ͬѹǿ�µ�ת����/% | |||
| 0.1MPa | 0.5MPa | 1MPa | 10MPa | |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������Լ��Ե�ԭ��CO32-+2H2O=H2CO3+2OH- | ||||
B��ϡ�����ϡ����������Һ��Ӧ���к��ȡ�H=-57.3 kJ/mol����ϡ������ϡ����������Һ������Ӧ���Ȼ�ѧ����ʽ��ʾΪ��
| ||||
| C��������Һ�еμ�����������Һ�����������ʵ������2Al3++3SO42-+3Ba2++6 OH-=2Al��OH��3��+3BaSO4�� | ||||
D��ͭ��Ũ�����ϼ��ȣ�2H2SO4��Ũ��+Cu
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ˮ��Ӧ��Na+H2O�TNa++OH-+H2�� |
| B������ˮ�⣺S2-+2H2O?H2S+2OH- |
| C��ϡ����������������Һ��Ӧ��Ba2++2OH-+2H++SO42-�TBaSO4��+2H2O |
| D��̼�������ᷴӦ��CaCO3+2H+�TCa2++H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH��ͬʱ�������ʵ���Ũ���ɴ�С��˳���Ǣ٣��ڣ��� |
| B�����ʵ���Ũ����ͬʱ����pH�ɴ�С��˳���Ǣ٣��ڣ��� |
| C���к͵������ռ���Һ��������ʵ���Ũ�ȵĢ٢ڢ���������Һ�������Ϊ2��2��1 |
| D����������ʵ���Ũ�Ⱦ���ͬ�Ģ٢ڢ�����Һ���ֱ���ͬŨ�ȵ��ռ���Һǡ����ȫ��Ӧ�������ռ���Һ�������Ϊ2��1��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��Na+��AlO-��OH-��C
| ||
B��Na+��Al3+��C
| ||
C��Fe2+��H+��N
| ||
D��Cl-��H+��Mn
|
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com