
 ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:
ClO2是一种高效水处理剂,某实验小组用如图所示装置制取并收集ClO2.已知:| 信息 | 内容 |
| ① | ClO2为黄绿色气体,极易溶于水,熔点为-59℃,沸点为11℃,具有强氧化性 |
| ② | ClO2易爆炸,若用惰性气体等稀释,则爆炸的可能性大降低 |
| ③ | HClO4、HClO2均是强酸,HClO4为无色透明液体,沸点为90℃;HClO2很不稳定,容易分解 |

分析 根据装置图可知,该 实验用草酸在酸性条件下还原氯酸钾制二氧化氯,装置B有冰水冷却产生的二氧化氯并收集,实验中尾气中含有二氧化氯等气体会污染空气,所以用氢氧化钠进行尾气吸收,由于ClO2极易溶于水,所以要用装置C防止氢氧化钠溶液倒吸,
(1)根据装置图可知仪器名称,用草酸在酸性条件下还原氯酸钾制二氧化氯,可得到二氧化氯和二氧化碳的混合气体,二氧化氯被稀释,可防止二氧化氯爆炸;
(2)根据上面的分析可知,装置C可以防止倒吸,装置B冷凝并分离出二氧化氯;
(3)由流程图可知,反应器中浓硫酸与氯酸钠反应生成ClO2、HClO4、硫酸氢钠,ClO2再经过反应可生成NaClO2,
①操作2为从溶液中获得HClO4为无色透明液体,即分离两种熔点不同的液体,可以用蒸馏的方法;
②根据盐类水解的原理,测定NaClO2溶液的PH值,可判断HClO2是否为强酸;
(4)用Na2S2O3溶液滴定I2,滴定终点时,I2完全反应,可以用淀粉溶液作指示剂,滴定终点时溶液由蓝色变为无色;根据元素守恒结合反应得到关系式2ClO2~5I2~10Na2S2O3计算c(ClO2).
解答 解:根据装置图可知,该 实验用草酸在酸性条件下还原氯酸钾制二氧化氯,装置B有冰水冷却产生的二氧化氯并收集,实验中尾气中含有二氧化氯等气体会污染空气,所以用氢氧化钠进行尾气吸收,由于ClO2极易溶于水,所以要用装置C防止氢氧化钠溶液倒吸,
(1)根据装置图可知a仪器名称为圆底烧瓶,用草酸在酸性条件下还原氯酸钾制二氧化氯,反应的方程式为2KClO3+H2C2O4=K2CO3+CO2↑+2ClO2↑+H2O,可得到二氧化氯和二氧化碳的混合气体,该反应的优点是二氧化氯被二氧化碳稀释,可防止二氧化氯爆炸,
故答案为:圆底烧瓶;2KClO3+H2C2O4=K2CO3+CO2↑+2ClO2↑+H2O;二氧化氯被二氧化碳稀释,可防止二氧化氯爆炸;
(2)根据上面的分析可知,装置C可以防止倒吸,装置B用冰水浴可以冷凝并分离出二氧化氯,
故答案为:防止倒吸;冷凝并分离出二氧化氯;
(3)由流程图可知,反应器中浓硫酸与氯酸钠反应生成ClO2、HClO4、硫酸氢钠,ClO2再经过反应可生成NaClO2,
①操作2为从溶液中获得HClO4为无色透明液体,即分离两种熔点不同的液体,可以用蒸馏的方法,
故答案为:蒸馏;
②证明HClO2为弱酸的方法是,在常温下测定NaClO2溶液的PH值,若PH值大于7,则为HClO2弱酸,
故答案为:在常温下测定NaClO2溶液的PH值,若PH值大于7,则为HClO2弱酸;
(4)用Na2S2O3溶液滴定I2,滴定终点时,I2完全反应,可以用淀粉溶液作指示剂,滴定终点时溶液由蓝色变为无色,且保持30s不变,由反应可得关系式:2ClO2~5I2~10S2O32-,可知V1mL×c(ClO2):V2mL×c(Na2S2O3)=2:10,则V1mL×c(ClO2):V2mL×c mol.L-1,故c(ClO2)=$\frac{cV{\;}_{2}}{5V{\;}_{1}}$mol/L,则其含量为 $\frac{cV{\;}_{2}}{5V{\;}_{1}}$mol/L×67.5g/mol=$\frac{13.5cV{\;}_{2}}{V{\;}_{1}}$g/L,
故答案为:淀粉溶液;溶液由蓝色变为无色,且保持30s不变;$\frac{13.5cV{\;}_{2}}{V{\;}_{1}}$g/L.
点评 本题考查物质制备实验与工艺流程,注意对题目信息的应用,较好的考查学生获取信息的能力与知识迁移运用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| B. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- | |
| C. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| D. | 向碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
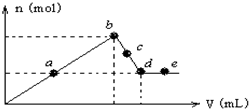 向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.
向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.| A. | a、c两点沉淀物成份相同,d、e两点沉淀物成份相同 | |
| B. | b-c段与c-d段溶液中阴离子的物质的量相等 | |
| C. | 在d点,向溶液中加入盐酸,沉淀量将减少 | |
| D. | 在反应过程中,各状态点溶液的pH大小顺序是:e>d>c>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当△H为负值时,表示该反应为吸热反应 | |
| B. | 反应热的大小只与反应体系的始态和终态有关 | |
| C. | 反应热的大小与反应物所具有的能量和生成物具有的能量无关 | |
| D. | 热化学方程式2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,表示2 L氢气和1 L氧气反应放出571.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
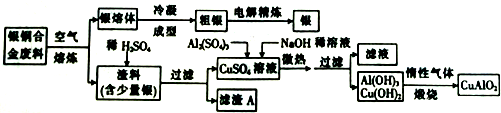
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH═CH2与C2H4 | B. | CH3COOCH3与CH3CH2COOCH3 | ||
| C. | 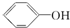 与 与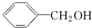 | D. | CH3CH2Cl与CH3CHClCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
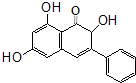 高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )| A. | 高良姜素的分子式为C15H15O5 | |
| B. | 高良姜素分子中含有3个羟基、8个双键 | |
| C. | 高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应 | |
| D. | 1mol高良姜素与足量的钠反应生成33.6LH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com