
【题目】在2L密闭容器中进行如下反应:N2+3H2![]() 2NH3,5min内氨的物质的量增加了0.1mol,则反应速率为
2NH3,5min内氨的物质的量增加了0.1mol,则反应速率为
A.v(H2)=0.02 mol/(L·min)
B.v(N2)=0.01 mol/(L·min)
C.v(NH3)=0.01 mol/(L·min)
D.v(N2)=0.03 mol/(L·min)
 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
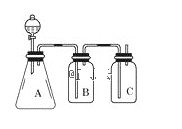
(1)若锥形瓶A中装某可溶性正盐溶液,其化学式为__。
(2)装置B所盛的试剂是__,其作用是__。
(3)装置C所盛试剂溶质的化学式是__。C中反应的离子方程式是__。
(4)由此可得出的结论是:酸性__>__>__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用 NaOH 标准溶液滴定未知浓度的盐酸,进行了如下实验:
取 15.00mL 待测溶液于 250mL 锥形瓶中,加入 1~2 滴酚酞试液,用 NaOH 标准溶液滴定。按上述操作方 法再重复 2 次。
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①装碱滴定管用蒸馏水洗涤后,直接加入 NaOH 标准溶液进行滴定,则待测液的浓度_____;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去 NaOH 标准溶液的体积_____;
③滴定时边滴边摇动锥形瓶,眼睛应观察_____;
④滴定达到终点时,酚酞指示剂由_____色变成_____色。
(2)滴定结果如下表所示:

若 NaOH 标准溶液的浓度为 0.1010mol/L,则待测液的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用微生物处理含 KCN 的废水。第一步是微生物在氧气充足的条件下,将 KCN 转化成 KHCO3和 NH3(最佳 pH:6.7~7.2);第二步是把氨转化为硝酸:NH3+2O2 ![]() HNO3+H2O。 请完成下列填空:
HNO3+H2O。 请完成下列填空:
(1) 写出第一步反应的化学反应方程式_____,第二步反应的还原产物是________________(填写化学式)。
(2) N 原子、H 原子、O 原子的半径由大到小的顺序是____________________。
(3) 碳原子的结构示意图为________________,水分子的电子式为_______________________。
(4) 室温下,0.1mol/LK2CO3、KCN、KHCO3 溶液均呈碱性且 pH 依次减小,则 0.1mol/L 的 KCN、KHCO3、K2CO3 溶液中,CN-、HCO3-、CO32-的物质的量浓度由大到小的顺序是_____。
(5) 工业上还常用氯氧化法处理含 KCN 的废水:KCN+2KOH+Cl2=KOCN+2KCl+H2O,2KOCN+4KOH+3Cl2=N2+6KCl+2CO2+2H2O。两者相比,微生物处理法的优点与缺点是(各写一条)。 优点:__________________,缺点:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。已知部分反应的热化学方程式如下:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJmol-1
O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJmol-1
H2(g)+![]() O2(g)=H2O(1)△H2=-285.8kJmol-1
O2(g)=H2O(1)△H2=-285.8kJmol-1
H2O(g)=H2O(l) △H3=-44kJmol-1
则CO2与H2反应生成气态CH3OH和水蒸气的热化学方程式为__。
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
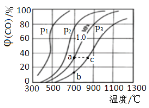
①压强p1__1.0MPa(填>、=或<)。
②900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,CO2的转化率为__,该反应的平衡常数Kp=__(保留小数点后一位数字)(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)①以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是___(写一条即可)。
CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是___(写一条即可)。
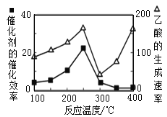
②在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。
(4)将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为___mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、为测定金属钠样品(表面有 Na2O)中钠单质的质量分数,设计了如下实验(反应装置如图所示):
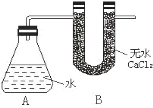
①称量 A、B 的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带 U 形干燥管(内含无水 CaCl2 干燥 剂)的橡皮塞 。有关数据是:称取的金属钠样品质量为 a g,A、B反应前总质量为 m g,反应后 A、B 的总质量为 n g。 请根据题意回答下列问题:
(1)A 中钠和水反应过程可看到钠浮在水面,产生这一现象原因是:_____________
(2)用 a、m、n 表示的钠单质的质量分数为_______________
(3)如果没有 B 装置对实验结果有何影响___________。(填“偏大”或“偏小”“不影响”)
Ⅱ、现用金属钠和空气制备纯度较高的 Na2O2,可利用的装置如下图。回答下列问题:
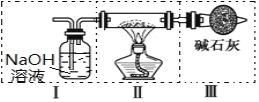
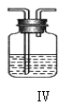
(4)上述装置Ⅳ中盛放的试剂是______,为完成实验应将装置Ⅳ接在_____(填写字母号)。
A.I 之前 B. II 和 III 之间 C.I 和 II 之间 D.III 之后
(5)点燃酒精灯后,观察到装置 II 中的现象为______________。
Ⅲ、现用制得纯度较高的 Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉_______(填“能”或“不能”)燃烧起来。
(7)盛有1.56 g Na2O2、3.36g NaHCO3的固体混合物放在密闭容器中加热,最后固体是___________(填化学式),质量为_________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废物利用有利于环境保护、资源节约,一种从废催化剂(含ZnO、CuO及少量石墨、Fe2O3及MnO2等)回收铜并制取活性氧化锌的工艺流程如图:
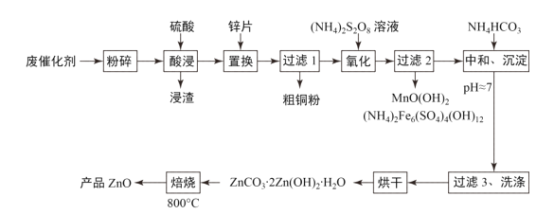
(1)为提高酸浸的速率,还可采取的措施为___。
(2)“氧化”时2molMn2+被氧化为MnO(OH)2,需要(NH4)2S2O8的物质的量为___。
(3)已知Zn(OH)2性质与Al(OH)3类似,在“中和、沉淀”时pH不能过大,请用文字结合离子方程式解释原因___。
(4)“过滤3、洗涤”时,对所得滤液蒸发浓缩、冷却结晶可得___(填主要物质的化学式)固体。
(5)“焙烧”过程中化学方程式为___。
(6)经测定,1kg废催化剂可得160g粗铜粉,又知粗铜粉中铜的质量分数为80%,则废催化剂中铜的质量分数为___%,若“酸浸”时硫酸浓度变小而又没有及时补充,则测定结果会比实际情况___(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.01mol·L-1MOH溶液的pH为10。已知:2MOH(aq)+H2SO4(aq)===M2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A. +33.1 kJ·mol-1 B. +45.2 kJ·mol-1
C. -81.5 kJ·mol-1 D. -33.1 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com