
少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体⑤加NaCl溶液 ⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10mL 0.1mol/L的盐酸.
|
| A. | ①⑥⑦ | B. | ③⑤⑧ | C. | ③⑦⑧ | D. | ③⑥⑦⑧ |
考点:
化学反应速率的影响因素.
专题:
化学反应速率专题.
分析:
产生氢气的量不变,则保证铁完全与盐酸反应;加快反应速率,应增大盐酸的浓度和升高温度.
解答:
解:①加水,稀释了盐酸的浓度,故反应速率变慢;
②加氢氧化钠,与盐酸反应,减少了盐酸的浓度,故反应速率变慢;
③加浓盐酸,反应速率加快;
④加醋酸钠固体与盐酸反应生成弱酸醋酸,故反应速率减慢;
⑤加氯化钠溶液,相当于稀释盐酸浓度,故反应速率变慢;
⑥滴加硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量;
⑦升高温度,反应速率加快;
⑧改用浓度大的盐酸,反应速率加快.
故选C.
点评:
本题考查了影响反应速率的因素.审题时要注意:加快反应速率和不改变氢气的量.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂表面积(S)和时间(I)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂表面积(S)和时间(I)的变化曲线如图所示。
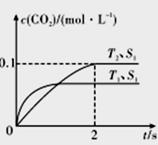
据此判断:
①该反应的△H_____________0(填“>”或“<”)。
②在T2温度下,0-2s内的平均反应速率v(N2) =____________mol/(L·s)。
③当固体催化剂的质量一定时,增大其表面积可增大化学反应速率。若催化剂的表面积S1>S2,在答题卡相应图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
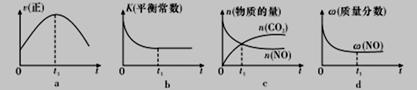
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_______________(填代号)。
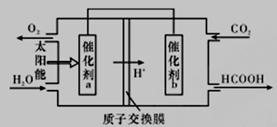
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
2NO2(g)=N2O4(g) △H=-867kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:_____________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应为_________________。
③常温下0. 1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka =_______________mol·L-1(填写最终计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
观察下列几个装置示意图,有关叙述正确的是 ( )
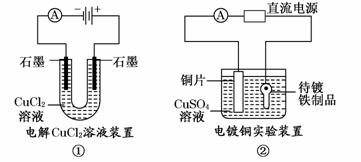
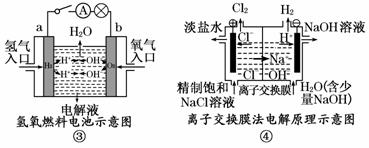
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③中外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是 ( )
A.1∶9 B.1∶1 C.1∶2 D.1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.3mol•L﹣1,c(SO42﹣)=0.8mol•L﹣1,则c(K+)为( )
|
| A. | 0.15mol•L﹣1 | B. | 0.2mol•L﹣1 | C. | 0.4mol•L﹣1 | D. | 0.6mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个体积为2L的容器中,充入4mol CO和4mol H2O,一段时间后反应CO(g)+H2O(g)⇌CO2(g)+H2(g)在密闭容器中达到了平衡状态.平衡后c[CO2]=1.8mol•L﹣1,则该温度下此反应的平衡常数K为( )
|
| A. | 27 | B. | 36 | C. | 54 | D. | 81 |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 ( )。
A.0.01 mol·L-1 B.0.017 mol·L-1
C.0.05 mol·L-1 D.0.50 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com