
【题目】A、B、C、D、E均为短周期元素形成的常见单质或化合物(注:A、B、C、D、E可代表各不相同的物质,也可以代表相同的物质),有以下转化关系:
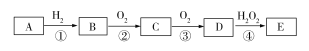
下列说法不正确的是
A. ①②③④步中均发生了氧化还原反应
B. A只能为非金属元素形成的单质
C. Al、Fe均可以在E的浓溶液中发生钝化
D. B、C、D、E均为共价化合物
科目:高中化学 来源: 题型:
【题目】氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMn04滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)判断滴定终点的方法是________________________。
(4)误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果________。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果________。
(5)计算:血液中含钙离子的浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取浓度均为0.2mol·L-1的醋酸溶液和氨水溶液各10 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是 ( )
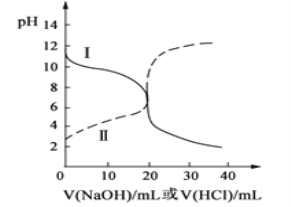
A. 曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
D. 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,常温下,有氧化还原反应(未配平):HFeO4-+(NH2)2CS+H2O→Fe(OH)3+(NH2)2CO+SO42-+OH,下列有关说法正确的是
A. HFeO4-为还原剂,Fe(OH)3为氧化产物
B. 氧化剂与还原剂反应的物质的量之比为4∶3
C. 随着反应的进行,溶液中c(H+)/Kw逐渐变小
D. 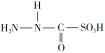 为此反应的中间产物,其中碳元素的化合价为0价
为此反应的中间产物,其中碳元素的化合价为0价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期,Y无最高正价,Z的含氧酸均具有氧化性,下列有关说法正确的是
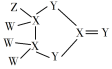
A. WZ沸点高于W2Y的沸点
B. 含Z的两种酸反应可制得Z的单质
C. W2Y2是由极性键和非极性键构成的非极性分子
D. X的含氧酸一定为二元弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。所发生的转化过程为CH3CH2CH2CH2OH![]() CH3CH2CH2CHO。
CH3CH2CH2CHO。

反应物和产物的相关物理性质如表所示。
性质 | 沸点/℃ | 密度/g·cm-3 | 水中溶解性 |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以上的馏分。将馏出物倒入分液漏斗中,分去水层,将有机层干燥后蒸馏,收集75~77℃馏分,产量为2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加入浓硫酸中,说明理由:___________。
(2)加入沸石的作用是___________,若加热后发现未加入沸石,应采取的正确措施是___________。
(3)上述装置图中,B仪器的名称是____,D仪器的名称是_______。
(4)将正丁醛粗产品置于分液漏斗中分离水时,水在______(填“上”或“下”)层。
(5)反应温度应保持在90~95℃,其原因是______________________。
(6)本实验中,正丁醛的产率为_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,原理如下:
(1)![]()
![]()
(2)![]()
![]()
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。
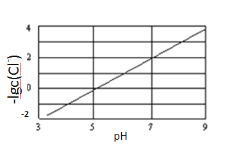
下列说法正确的是( )
A. 溶液pH越大,Ksp(CuCl)增大
B. 反应达到平衡时增大c(Cu2+),c(Cl-)减小
C. 该过程中,Cu+起到了催化剂的作用
D. 从反应自发性角度分析,如反应(2)能自发进行,则b>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。
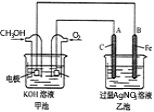
(1)甲电池是_________装置,乙池是_________装置。
(2)通入CH3OH的电极名称是_______,A(石墨)电极的名称是________。
(3)通入O2的电极的电极反应式是________________________。B(Fe)电极的电极反应式为___________________________。
(4)乙池中反应的化学方程式为___________________________。
(5)当乙池中B(Fe)极的质量增加5.40g时,甲池中理论上消耗O2_____mL(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com