
| A. | 蒸馏 | B. | 萃取和分液 | C. | 过滤 | D. | 分液 |
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | FeCl3 | HBr | H3PO4 | Cu(OH)2 |
| 弱电解质 | CH3COOH | HF | BaSO4 | HI |
| 非电解质 | Cu | NH3 | H2O | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol CO2中含有原子数NA | |
| B. | 1L1mol/L的硫酸钠溶液中,所含Na+数为NA | |
| C. | 标准状况下,11.2 L水所含分子数为0.5NA | |
| D. | 1mol Fe含有原子数NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
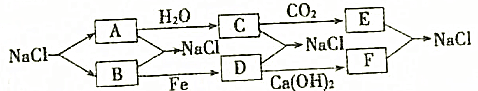
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com