
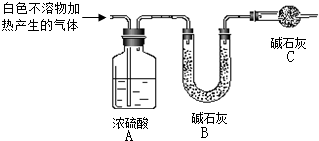
 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如下实验探究反应原理并验证产物.
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如下实验探究反应原理并验证产物.| 实验序号 | 实 验 | 实验现象 | 结 论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为 |
| 实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量 | 白色不溶物中含有MgCO3 | |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 量 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32-离子 |
| 84 |
| 44 |
| x |
| 1.76 |
| 3.36 |
| 84 |
| 1.16 |
| 58 |


科目:高中化学 来源: 题型:
| A、1.00molNaCl中含有NA个NaCl分子 |
| B、欲配制1.00L,1.00mol.L-1的NaCl溶液,可将58.5gNaCl溶于 1.00L水 |
| C、1.12L Cl2含有1.7NA个质子 |
| D、1molCl2与足量的铁反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:2:3 |
| B、1:1:3 |
| C、1:1:1 |
| D、3:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
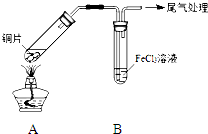 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.| 步骤① | 配制1mol?L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
| 步骤② | 往5mL 1mol?L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol?L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
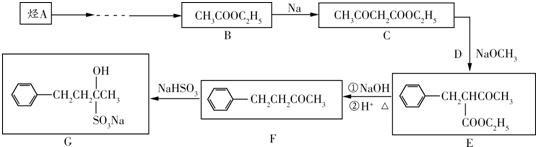
| 酸或酶 |
| 酒化酶 |
| ①NaOH |
| ②H+△ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、铜丝表面有气泡产生 |
| B、铁钉上发生的反应为:Fe-2e-=Fe2+ |
| C、一段时间后铁钉上出现红色物质 |
| D、如果把铜丝换成镁条,会加快铁钉的溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、剩余40mL气体一定是O2 |
| B、剩余40mL气体是H2S或SO2 |
| C、混合气体中含H2S 40mL或80mL |
| D、剩余40mL气体是SO2和O2混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
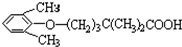 是常用的降血脂药物之一.下列有关它的说法正确的是( )
是常用的降血脂药物之一.下列有关它的说法正确的是( )A、它是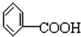 的同系物 的同系物 |
| B、它能发生加成、取代、消去等反应 |
| C、它可使酸性KMnO4溶液褪色,但不能与溴水反应使其褪色 |
| D、它苯环上的一氯代物有三种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com