
17克NH3共有 mol电子,0.1molH2S共有约 个分子,
同温同压下,同体积的NH3和H2S气体的质量比为 ;
同温同压下,同质量的NH3和H2S气体的体积比为 ;
同质量的NH3和H2S中氢原子的个数比为 。
10 6.02×1022 1:2 2:1 3:1
解析试题分析:n(NH3)=m/M=17g÷17g/mol=1mol。N(电子)=10×1mol=10mol。因为:n=N/NA所以N=" n" NA=0.1×6.02×1023= 6.02×1022。同温同压下,同体积的任何气体具有相同的体积。它们的物质的量也相等。这时同体积的氨气与硫化氢的质量比等于它们的摩尔质量之比。即为17:34="1:2." 同温同压下,同质量的NH3和H2S气体的体积比为(m÷17g/mol):(m)÷34g/mol)="2:1." 同质量的NH3和H2S中氢原子的个数比为(2×3):(1×2)=3:1.
考点:考查物质的量与质量、体积摩尔质量的关系及微粒与构成它的原子的关系等知识。


科目:高中化学 来源: 题型:填空题
某小组用铜屑制取硫酸铜溶液。将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气其反应原理为2Cu+O2+2H2SO4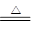 2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
(1)参加反应的氧气在标准状况下的体积是 。
(2)所得硫酸铜溶液的物质的量浓度是 。
(3)取100 mL上述硫酸铜溶液,加水稀释至0.1 mol/L,稀释后硫酸铜溶液的体积是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在实验室中,氮氧化物废气(主要成分NO2和NO)可以用NaOH溶液来吸收,除去这些废气,其主要反应为:2NO2 +2 NaOH →NaNO2 + NaNO3 + H2O NO + NO2 + 2NaOH → 2NaNO2 + H2O
(1)2molNO和2.4molNO2混合气体通入NaOH溶液被完全吸收时,生成的NaNO2
是_______mol;生成的NaNO3是_______mol 。
(2)NO和NO2的混合气体的组成可表示为NOX ,该混合气体通入NaOH溶液被
完全吸收时,x的值可以为 (填编号)。
a.1.1 b.1.2 c.1.5 d.1.8
(3)若用纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2。
请写出纯碱溶液吸收NO2的化学方程式:____________________
(4)现有标准状况下a升NO2(其中N2O4体积分数为20%)和b升NO的混合气恰好被200mL Na2CO3溶液完全吸收,则a、b应满足的关系为: ;该Na2CO3溶液的物质的量浓度为 ________mol/L(用含a、b的代数式表示)。
(5)若在标准状况下,2.016 L氮氧化物的混合气和0.896LO2与1mol/LNa2CO3溶液50mL恰好反应生成NaNO3,则混和气体中N2O4与NO2的体积比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol/L的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制溶液除烧杯和玻璃棒,还需要的仪器是 、 、 。
③实验开始时,需要检查 。
④配制时,下列操作正确的顺序是(用字母表示) 。
A.洗涤 B.定容 C.溶解 D.摇匀 E.冷却 F.称量 G.转移
⑤在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面( )
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水( )
Ⅲ.配制时,容量瓶有少量蒸馏水( )]
Ⅳ.定容时仰视刻度线( )
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为 ,所得溶液中的溶质物质的量浓度为 mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液溶质物质的量浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请完成下列填空:
(1)当SO2和SO3中分子个数比为1∶1 时,原子总数之比为 ,质量之比为 。
(2)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为 g。
(3)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol—1,则:
①该气体的物质的量为 mol。
②该气体在标准状况下的体积为 L。
③该气体溶于水后形成V L溶液(不考虑反应),其溶液的物质的量浓度为 mol·L—1。
(4)将5 mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是 mol·L—1。
(5)用等体积的0.1 mol·L—1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42—完全沉淀,则三种硫酸盐的物质的量浓度之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用Na2CO3固体配制1mol/L的Na2CO3溶液100mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③酒精灯;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50mL烧杯;应选用的仪器(填编号) 。
(2)应称取Na2CO3的质量为 g;若称量时砝码和物品放反了,则实际称量的Na2CO3的质量为 g 。
(3)下列操作,会引起所配溶液浓度偏高的是( )
| A.称取的Na2CO3固体中有杂质 |
| B.溶解Na2CO3固体时,因搅拌剧烈使烧杯中的溶液溅出少量 |
| C.没有洗涤烧杯及玻璃棒 |
| D.定容时发现液面高于刻度线,用胶头滴管吸出多余的溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
向50mL稀硫酸和稀盐酸的混合溶液中,加入3.42g氢氧化钡粉末,充分反应后过滤,得到干燥的沉淀物2.33g,所得溶液中氢氧根离子的浓度为0.1mol/L,试求原混合液中 和
和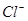 的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com