
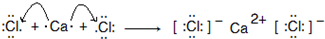 .
. 分析 (1)中子数不同质子数相同的原子为同种元素的不同核素互为同位素,同位素的化学性质是相似;
(2)金属铝和强碱反应产物是盐和氢气,所以Be与氢氧化钠溶液反应的产物是一种盐和氢气;
(3)比较元素的金属性强弱,可根据金属与水、酸反应的剧烈程度、对应的最高价氧化物的水化物的碱性强弱、单质间的置换反应等判断,以此解答该题;
(4)Ar具有18个电子,与Ar同周期的非金属元素得电子后与Ar电子数相同;根据电子式的书写方法来书写即可.
解答 解:(1)10Be和9Be是中子数不同、质子数相同的Be原子,互为同位素,它们的化学性质相似;
故答案为:CD;
(2)金属铍和氢氧化钠反应的化学方程式为:Be+2NaOH═Na2BeO2+H2↑,
故答案为:Be+2NaOH═Na2BeO2+H2↑;
(3)A.硬度和熔点属于物理性质,不能用于比较金属性,故A错误;
B.将打磨过的镁带和铝片分别和同浓度同体积的盐酸反应,Mg与HCl反应比Al与盐酸反应更剧烈,说明Mg比Al活泼,能证明金属性强弱,故B正确;
C、将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液,发现放镁带的那个变红色,证明金属镁可以和热水反应,但是金属铝不可以,能证明金属性强弱,故C正确;
D.将空气中久置的镁带和铝片分别置于热水中,由于二者表面有氧化膜,所以不与水反应,均无现象,故D错误;
故答案为:BC;
(4)Ar具有18个电子,与Ar同周期的非金属元素得电子后与Ar电子数相同,Ar核外电子排布相同的简单阴离子是硫离子和氯离子;与钾相邻元素的离子是钙离子,氯化钙可以做干燥剂,属于离子化合物,电子式为: ,用电子式表示该化合物的形成过程为
,用电子式表示该化合物的形成过程为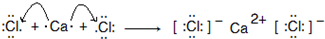 ;
;
故答案为:S2-、Cl-;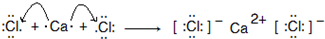 .
.
点评 本题涉及同位素的概念、元素金属性强弱的判断、微粒半径大小比较方法以及电子式的书写知识,属于综合知识的考查,难度中等,侧重于考查学生对基础知识的综合应用能力.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
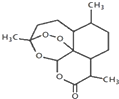 我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法合理的是( )
我国科学家屠呦呦获2015年诺贝尔生理学或医学奖.她研究得到的青蒿素挽救了数百万疟疾病人的生命,有关青蒿素说法合理的是( )| A. | 化学式为C15H20O5 | |
| B. | 只含有氧原子一种官能团 | |
| C. | 能发生取代反应和氧化反应 | |
| D. | 可用乙醇从青蒿浸取液中萃取出青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维--Si | B. | 熟石灰--CaO | ||
| C. | 水煤气--CO、H2 | D. | 绿矾--Fe2(SO4)3•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8 mol•L-1•s-1 | B. | v(A2)=0.4 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(B2)=0.42 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气质量日报的主要目的是树立人们环保意识,同时也让人们知道了二氧化硫、二氧化氮和可吸入颗粒物是大气主要污染物 | |
| B. | 酸雨是指pH小于7的雨水 | |
| C. | 为了减少二氧化硫和二氧化氮的排放,工业废气排放到大气之前必须进行回收处理 | |
| D. | 食品厂产生的含丰富氮、磷营养素的废水不可以长期排向水库 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CH3OH | CH3OCH3 | H2O |
| t1 | 0.8 | 1.24 | 1.24 |
| t2 | 0.08 | 1.6 | 1.6 |
| A. | 平衡后升高温度,平衡常数>400 | |
| B. | t2时刻反应达到平衡状态 | |
| C. | 平衡时,反应混合物的总能量减少20kJ | |
| D. | 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com