
【题目】已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O,IO3﹣、MnO4﹣、IO4﹣ .
①有关反应的离子方程式为 .
②在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1L,测得溶液的pH=2,求在反应中转移电子的物质的量 .
【答案】2Mn2++5IO4﹣+3H2O=2MnO4﹣+5IO3﹣+6H+;0.0167mol
【解析】解:①锰离子失电子被氧化生成高锰酸根离子,所以锰离子作还原剂,氧化剂得电子化合价降低,IO3﹣和IO4﹣中碘元素的化合价分别是+5价和+7价,所以IO4﹣作氧化剂,还原产物是IO3﹣ , 同时水参加反应生成氢离子,所以该反应的离子方程式为:2Mn2++5IO4﹣+3H2O=2MnO4﹣+5IO3﹣+6H+ ,
所以答案是:2Mn2++5IO4﹣+3H2O=2MnO4﹣+5IO3﹣+6H+;
②2Mn2++5IO4﹣+3H2O=2MnO4﹣+5IO3﹣+6H+反应中当转移10mol电子时,生成6mol氢离子,或者反应后的溶液稀释到1L,测得溶液的pH=2,则n(H+)=1L×0.01mol/L=0.01mol,所以转移电子为 ![]() =0.0167mol;
=0.0167mol;
所以答案是:0.0167mol.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿浆(主费成分是MnO2)吸收工业要气中的SO2,并制备硫酸锰的生产流程如下(浸出液的pH<2,其中除含Mn2+外。还含有少量Fe2+、Al3+、Ca2+等金属离子):
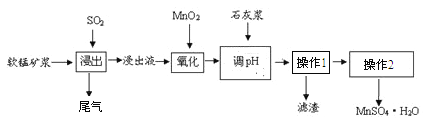
操作1的滤液通过阳离子吸附剂除去Ca2+。金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
请回答下列问题:
(1)浸出过程中被氧化的物质的化学式为____________________________。
(2)氧化过程中主要反应的离子方程式_________________________________。
(3)在氧化后的液体中加入石灰浆调节pH,pH的范围是_____________________。
(4)操作1的名称是________,操作2包括蒸发浓缩、______过滤、洗涤、干燥等操作。
(5)为测定所得MnSO4·H2O的纯度,准确称取上述样品1.720g加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配成200mL溶液。取20.00mL该溶液,向其中逐滴加入0.0500mol/L的FeSO4溶液,发生如下反应:Fe2++Mn3+=Fe3++Mn2+。当反应恰好完全进行时,共消耗FeSO4溶液19.50mL。通过计算确定MnSO4·H2O的纯度(写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,恒压装置中N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ·mol-1,。N2的平衡转化率(
2NH3(g) △H=-92.4kJ·mol-1,。N2的平衡转化率(![]() )与体系总压强(P)的关系如图所示。下列说法正确的是:
)与体系总压强(P)的关系如图所示。下列说法正确的是:

A. 平衡状态由A变到B时,平衡常数K(A)<K(B)
B. 上述反应在达到平衡后,充入He气,H2的转化率减小
C. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
D. 将1mol氮气、3mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为:8HClO3═3O2↑+2Cl2↑+4HClO4+2H2O.根据题意完成下列小题:
①在上述变化过程中,发生还原反应的过程是→(填化学式).
②该反应的氧化产物是(填化学式);求所得混合气体的平均相对分子质量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ
C.由C(s,石墨)=C(s,金刚石)△H=+1.90kJ/mol可知,石墨没有金刚石稳定
D.在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=﹣285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是 ( )
CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是 ( )

① ② ③ ④
A. ①表示随温度升高,平衡常数的变化
B. ②表示加入催化剂,反应速率随时间的变化
C. ③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化
D. ④表示CO的体积分数随充入Cl2量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L Na2SO4溶液中含Na+ 4.6 g, 则溶液中SO42- 浓度为
A. 0.1mol/LB. 0.4mol/L
C. 0.6mol/LD. 0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废渣中混有少量的锌粉和氧化铜(其他成分不跟酸反应),跟大量废盐酸接触形成污水,产生公害。若向污水中撒入铁粉且反应后铁粉有剩余,此时污水中一定含有的金属离子是
A. Fe2+、Cu2+B. Zn2+、Fe2+C. Cu2+、 H+D. Zn2+ 、H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com