
【题目】小王同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A.Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B.由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C.CO2作氧化剂,表现氧化性,发生氧化反应
D.Mg原子得到的电子数目等于碳原子失去的电子数目
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】丁二酮肟可用于镍的检验和测定,其结构式如图:
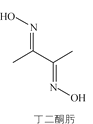
(1)Ni元素基态原子价电子排布式为________,C、N、O第一电离能由大到小的顺序是________。
(2)1mol丁二酮肟含有的σ键数目是________,碳原子的杂化方式为________。
(3)丁二酮肟镍分子内含有的作用力有________(填字母)。
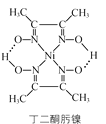
a.配位键 b. 离子键 c. 氢键 d. 范德华力
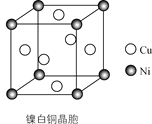
(4)某镍白铜的晶胞如图所示,其化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国学者近期发表在 Green Chemistry 的研究成果是将电解食盐水的阳极反应与电催化还原 CO2 的阴极反应相耦合,反应原理的示意图如图所示。下列说法错误的是

A.阳极反应为2Cl--2e- = Cl2↑
B.装置中的离子交换膜是质子交换膜
C.整个反应过程中碳、氯、氧的原子利用率接近 100%
D.这种耦合为提高 CO2 电化学还原的实际应用提供了思路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银系列产品广泛地应用于化工、电子电锁、材料和工业催化等领域,对含银废料中贵金属银的综合回收具有重要的研究意义。一种对银粉和 AgNO3 生产过程中产生的含银废料进行综合回收的工艺流程如图:
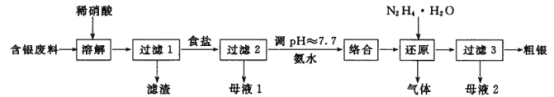
回答下列问题:
(1)“溶解”反应的化学方程式为 ______。稀硝酸能否用浓硫酸代替____(填“能”或“不能”),原因是______________。
(2)“过滤3”操作中用到的玻璃仪器是_____________。
(3)“络合”步骤中需要加氨水调pH≈7.7,生成的络合物为_____________。
(4)N2H4H2O称水合肼,具有强还原性和碱性。水合肼与硫酸反应生成正盐的化学式为_______。
(5)“还原”步骤中产生的气体可参与大气循环,该气体分子的电子式为_______。
(6)“母液 2”中溶质的化学式为______________。
(7)粗银经过烘干、焙烧、电解得到纯度99. 9% 的银。
①焙烧是在中频炉中进行 ,中频炉优点是加热升温速度快,氧化烧损仅为 0.5%, 在此焙烧目的是_______。
②电解时粗银做电极阳极,阴极为不锈钢板 ,电解液为 AgNO3 、HNO3 、KNO3 混合溶液,电解液中HNO3 和 KNO3 的作用分别是__________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
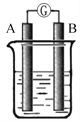
序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
1 | Zn | Cu | 稀硫酸 | 有 |
2 | Zn | Zn | 稀硫酸 | 无 |
3 | Cu | C | 氯化钠溶液 | 有 |
4 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述数据,回答下列问题:
(1)实验1中电流由________极流向_______ 极(填“A”或“B”)
(2)实验4中电子由B极流向A极,表明负极是_________电极(填“镁”或“铝”)
(3)实验3 表明 ______
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是____________
A.相对活泼的金属一定做负极
B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】螺环化合物是指分子中两个环共用一个碳原子的化合物。甲、乙、丙三种有机物的结构如图所示。
甲: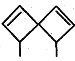 乙:
乙: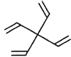 丙:
丙: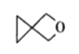
下列说法中正确的是
A.甲、乙、丙都属于螺环化合物
B.丙是环氧乙烷(![]() )的同系物
)的同系物
C.甲、乙互为同分异构体
D.甲、乙、丙分子中所有碳原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是___。
A.放在棕色瓶中 B.放在细沙中 C.放在水中 D.放在煤油中
(2)钠长时间放在空气中,最后的产物主要成分是___。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
(3)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式___,生成物的颜色为___。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的离子方程式为___,检验该反应产生的气体的方法是___。
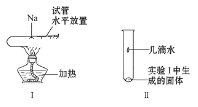
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是_____,X和Y中电负性较大的是__(填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。
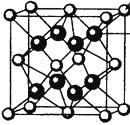
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com