
| A. | 15N与14N互为同位素 | B. | 13C与14C互为同素异形体 | ||
| C. | 13C与15N具有相同的中子数 | D. | 15N的核外电子数与中子数相同 |
分析 A.具有相同的质子数,不同的中子数的原子,互为同位素;
B.同种元素形成的不同单质互为同素异形体;
C.根据中子数=质量数-质子数进行计算;
D.根据核外电子数=质子数,中子数=质量数-质子数进行计算.
解答 解:A.15N与14N的质子数相同,中子数不同,故互为同位素,故A正确;
B.13C与14C都是碳原子,不是单质,互为同位素,故B错误;
C.13C的中子数=13-6=7,15N的中子数=15-7=8,中子数不同,故C错误;
D.15N的核外电子数=质子数=7,中子数=15-7=8,核外电子数与中子数不相同,故D错误;
故选A.
点评 本题考查同位素的概念及粒子间的数量关系,难度不大.要注意对于原子而言:核外电子数=质子数,中子数=质量数-质子数,侧重于考查学生对基础知识的应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
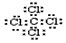 ,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.
,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CH2=CH2分子中,存在4个σ键和一个π键 | |
| B. | NH3、CO、CS2都是极性分子 | |
| C. | N、O、F电负性大小:F>O>N;第一电离能大小:N>F>O | |
| D. | H2O的沸点比HF的沸点高,是由于水中氢键键能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaBr+Cl2═2NaCl+Br2 | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 2H2S+SO2═2H2O+3S↓ | |
| D. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的非金属元素都分布在p区 | |
| B. | 元素周期表中ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 在同一主族中,自上而下第一电离能逐渐减小 | |
| D. | 第ⅠA、ⅡA族元素的原子,其半径越大,电负性越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑥ | B. | ①③⑥ | C. | ①③⑤⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3、MgC12 | B. | NH4HCO3、AlC13 | C. | (NH4)2CO3、BaCl2 | D. | NH4HCO3、MgC12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com