
分析 (1)NaHSO4溶液与NaHCO3溶液反应生成硫酸钠、水和二氧化碳;
(2)KClO3+6HCl $\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O中,Cl元素的化合价由+5价降低为0,Cl元素的化合价由-1价升高为0,以此来解答;
(3)①根据还原剂的还原性强于还原产物的还原性;
②氯气和溴化亚铁以物质的量之比为3:4,设氯气的物质的量为3mol,则溴化亚铁的物质的量为4mol,而4mol的亚铁离子失去4mol的电子,而氯气需得到6mol的电子,所以参加反应的亚铁为2mol,由此分析解答.
解答 解:(1)NaHSO4溶液与NaHCO3溶液反应生成硫酸钠、水和二氧化碳,离子方程式:H++HCO3-═CO2↑+H2O,
故答案为:H++HCO3-═CO2↑+H2O;
(2)KClO3+6HCl $\frac{\underline{\;\;△\;\;}}{\;}$KCl+3Cl2↑+3H2O中,Cl元素的化合价由-1价升高为0,失去电子被氧化,5molHCl作还原剂,对应氧化产物;
Cl元素的化合价由+5价降低为0,得到电子被还原,对应还原产物,所以氧化剂与还原剂的物质的量的比为1:5,
氯气既是氧化产物又是还原产物,
由Cl原子守恒可知,氧化产物与还原产物的质量比为5:1,
故答案为:①1:5;②5:1;
(3)①根据还原剂的还原性强于还原产物的还原性,由:2Fe2++Cl2=2Fe3++2Cl-,还原性:Fe2+>Cl-;由2Fe2++Br2═2Fe3++2Br-,还原性:Fe2+>Br-;由 2Br-+Cl2═Br2+2Cl-还原性:Br->Cl-;故答案为:Fe2+>Br->Cl-;
②氯气和溴化亚铁以物质的量之比为3:4,设氯气的物质的量为3mol,则溴化亚铁的物质的量为4mol,而4mol的亚铁离子失去4mol的电子,而氯气需得到6mol的电子,所以参加反应的亚铁为2mol,离子反应方程式为:4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-,故答案为:4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,题目难度不大.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.24 L | B. | 1.68 L | C. | 3.36 L | D. | 1.12 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
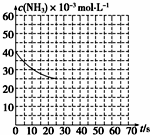 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 | 1.77×10-5 |
| Ka2=5.61×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 其中氧化剂是MnO2,氧化产物是Cl2,氧化剂和还原剂物质的量之比是1:2.
其中氧化剂是MnO2,氧化产物是Cl2,氧化剂和还原剂物质的量之比是1:2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 离子方程式 | |
| ①KCl (K2SO4) | ||
| ②Na2SO4 (MgSO4) | ||
| ③NaCl (Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H++OH-═H2O | |
| B. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| C. | 利用铝热反应焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 用氯水除去FeCl2溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| B. | 在铁板表面涂抹油漆,不能防止铁板被腐蚀 | |
| C. | 钢铁在干燥空气中不易被腐蚀 | |
| D. | 用牺牲锌块的方法来保护船身 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com